Krebs
Krebszellen unterliegen nicht mehr der normalen Wachstumskontrolle,
sind potentiell unsterblich (Immortalisierung) und bei einigen
Krebszellen findet man die Fähigkeit, Metastasen auszubilden, d.h. in
ein anderes Gewebe einzudringen und dort ebenfalls Krebszellen zu
bilden.
Bei einer Zellline aus den Wirbeltieren ist es normalerweise das
Problem, das diese nach einiger Zeit eine Krise erleben und
sterben. Dieser Vorgang findet bei einer etablierten Zelllinie nicht
statt. Diese Zellen bilden dann zwar keinen Krebs, allerdings zeigen
sie einige charakteristische Veränderungen: Sie sind von einer
Verankerung an einer Oberfläche abhängig, sie sind von Serum oder GF
abhängig, sie zeigen eine dichteabhängige Inhibition und weisen in der
Organisation des Zellskeletts eine Anpassung an die flache Form auf.
So wachsen die Zellen in vitro in Form eines Monolayers.
Diese Zellen weisen ausserdem zumeist einen aneuploiden, d.h. nicht
diploiden Chromosomensatz auf.
Wenn man eine Zellkultur aus einem Tumor gewinnt, werden diese als
transfortmiert bezeichnet. Diese unterliegen weniger den oben
genannten Wachstumskontrollen.
Substanzen, die zu einem Krebswachstum führen werden als Carcinogene
bezeichnet.
Als Oncogene bezeichnet man die Gene, die wichtige Wachstumskontollen
bilden. Man kennt meist zu dem zellulären Gen auch ein virales Gen,
das einen Tumor auslöst. Das zelluläre Gen wird als Protoonkogen
bezeichnet. Tumorsupressoren verhindern die Entstehung eines Tumors
und werden im Allgemeinen durch Deletionen entdeckt.
Die Transformation einer Zelle zu einem Tumor kann spontan stattfinden
oder durch einen Tumorvirus induziert sein. Die Wirkung eines Virus
ist zumeist auf ein Onkogen zurückzuführen, das der Virus in einer
modifizierten Form in die Zelle einbringt. Eine Zelle kann auf zwei
Arten auf einen Virus reagieren: Permissive Zellen werden durch die
Infektion lysiert und setzen neue Viren frei. Bei den Nichtpermissiven
Zellen hingegen findet eine Transformation durch die Integration des
Virus in das Genom statt. Die Zellen werden nicht lysiert und beginnen
sich unkontrolliert zu vermehren.
Als Papylomaviren, zu denen SV40, BK und JC gehören, führen bei der
produktiven Infektion (bei der es zur Lyse kommt) ein alternatives
Spleissen durch. Bei einer transformierten Zelle werden Kopien des
Genoms in das Genom der Zelle integriert. Die transformierende Wirkung
beruht darauf, dass die synthetisierten Proteine in der Lage sind, mit
zellulären Proteinen in Wechselwirkung zu treten.
Die Adenoviren verursachen vor allem Erkrankungen der Atemwege. Beim
Menschen sind die Zellen permissiv und werden normal infiziert. Bei
den Nagern finden sich jedoch auch nichtpermissive Zellen. Diese
werden von den Adenoviren transformiert, indem Teile der frühen Gene
in das Genom integriert werden.
Die Retroviren können vertikal (an die Nachkommen) und horizontal an
andere Tiere weiter gegeben werden. Nichtdefektive Viren durchlaufen
den normalen Lebenszyklus und wirken über infektiöse Agentien auf die
Zelle ein. Die akut transformierenden Viren tragen genetische
Informationen in Form eines Oncogens und führen so zu einem Tumor.
Wenn ein Virus ein fremdes Gen aufnimmt, kann er sich normalerweise
nicht mehr selbst replizieren, können sich aber häufig dadurch
verbreiten, dass sich entweder die Zelle unkontrolliert teilt oder
wenn zugleich eine Infektion mit einem Wildtyp erfolgt.
Die transformierenden Viren tragen immer ein Oncogen, das von einem
Protoonkogen der Zelle abstammt. Die virale Variante wird
normalerweise durch ein v-, die zelluläre durch ein c-
gekennzeichnet. Die onkogene Wirkung dieser Gene wird von zwei
unterschiedlichen Modellen erklärt: Das quantitative Modell erklärt
die onkogene Wirkung durch eine Überexpression, das qualitative durch
eine Mutation im viralen Onkogen.
Die Fähigkeit einer DNA, einen Tumor auszubilden kann man entweder
testen, indem man eine etablierte Zellinie mit der DNA transfiziert
oder indem man tranformierte Zellen in nackte Mäuse (ohne Immunabwehr)
gibt. Bei DNA, die die Zellen erfolgtreich transformiert findet man
immer eine zelluläre DNA, die dieser sehr ähnlich ist und man findet
entsprechende DNA auch in transformierenden Viren.
Bei dien Tests fand man häufig Gene der c-ras-Familie. Ihre Proteine
sind alle ca. 21 kD gross und werden deshalb als p21ras
bezeichnet. Man findet bei voneinander unabhängigen Tumoren sehr
häufig eine Deletion an den Positionen 12 und 61. Man hat
herausgefunden, dass das sowohl eine Mutation im zellulären ras als
auch eine Überexpression des ,,normalen`` ras eine Zelle
transformieren kann.
Bei einigen Protooncogenen kommt es auch dehalb zu einem Tumor, da
deren Expression, nicht aber ihre Sequenz geändert wird. Bei c-myc
kann dies auf unterschiedliche Arten geschehen. In diesen Fällen
enthält der Virus kein Onkogen, sondern aktiviert ein zelluläres Gen
durch die Aktivität seines LTR (long terminal repeat). Indem sich der
Virus entweder in das c-myc Gen integriert und einen Promotor für
dessen Transkription zur Verfügung stellt oder indem es durch
Integration in das Gen oder in dessen Nähe als Enhancer wirkt, löst er
einen Tumor aus.
Bei der reziproken Transklokation wird das Onkogen durch eine
Translokation an eine andere Stelle des Chromosoms aktiv. Wird c-myc
an einen Ig-Lokus transloziert, wird es auf hohem Niveau
exprimiert. Diese Expression auf hohem Niveau wirkt onkogen.
Man findet auch bei anderen Genen eine onkogene Wirkung auf Grund der
Translokation. Zumeist entstehen so Fusionsproteine, die unter der
Kontrolle des einen Promotors steht. In anderen Fällen entsteht ein
Enhancer in der Nähe des Gens und beeinflusst dieses so.
Eine Translokation ist auch bei den Philadelphiachromosom, einer
Translokation von dem End von Chromosom 9 auf Chromosom 22 der
Auslöser für die chronisch-myeloische Leukämie. Dort entsteht ein
onkogenes Fusionsprotein.
c-myc kann durch einen Retrovirus, durch Amplifikation des Gens
und durch dessen Translokation aktiviert werden.
Onkogene wirken zumeist ähnlich den Mechanismen zur Kontrolle der
Entwicklung, indem sie den Weg einer Zelle an einem bestimmten Punkt
gezielt ändern. Die bisher identifizierten Zellen lassen sich wie
folgt einteilen:
- Wachstumsfaktoren
- Rezeptoren für Wachstumsfaktoren
- Intrazelluläre Proteinkinasen
- Stoffe der Signalübertragung wie c-ras
- Serin/Threonin-Proteinkinasen
- Kernproteine (Transkriptionsfaktoren)
Die Mitwirkung dieser Faktoren an der Veränderung des Phänotyps kann
deren onkogenen Charakter erklären. Je weiter am Anfang des
Reaktionsweges ein Onkogen liegt, auf umso mehr Wege hat es einen
Einfluss und umso stärker ist seine Wirkung.
Bei den Rezeptoren für Wachstumsfaktoren berüht der onkogene Effekt
meist auf einer Mutation, die eine konstitutive Aktivierung erzeugt
und so Krebs auslösen können. Normalerweise wird der Rezeptor durch
dne Wachstumsfaktor zur Dimerisierung angeregt und beginnt dann mit
der Autophosphorylierung. Dieser Prozess läuft bei dem mutierten
Rezeptor spontan ab. Die ersten untersuchten Onkogene vom
Tyrosinkinasetyp waren die Src-Proteine. Das Protein findet man vor
allem an der cytoplasmatischen Seite der Endosomen und in der Umgebung
von Zell-Zell-Kontakten. Sowohl bei c-Src als auch bei v-Src wird die
N-Terminale Seite abgespalten und durch eine Fettsäure ersetzt. Diese
dient dem Anheften an die Membran und ist für die onkogene Wirkung
entscheidend. Die Kinaseaktivität von v-Src ist ca. 20fach so hoch wie
die von c-Src und wirkt über die Phosphorylierung von Zielproteinen
onkogen. Die normale Aufgabe von c-Src konnt noch nicht geklärt
werden. Normalerweise wird Src durch Bindung an eine phosphorylierter
Rezeptortyrosinkinase aktiviert.
In einigen Fällen wirken die Onkogene auch dirket in Form von
Transkriptionsfaktoren wie myc, myb fos, jun oder rel. Durch eine
Veränderung der Transkription kann die Expression von Genen entweder
erhöht oder erniedrigt werden und so zu einem onkogenen Effekt
führen.
Bei dem Gen rel wurde der Mechanismus, nach dem der onkogene Faktor
wirkt genau untersucht. Zu der Familie der rel-Gene gehört unter
anderem der Faktor NF-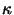 B, ein Dimer aus den Untereinheiten p65
und p50. Der Faktor wird normalerweise durch I- B, ein Dimer aus den Untereinheiten p65
und p50. Der Faktor wird normalerweise durch I-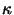 B im Cytoplasma
festgehalten. Wird I- B im Cytoplasma
festgehalten. Wird I-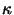 B phosphoryliert, wandert NF- B phosphoryliert, wandert NF-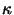 B in
den Kern und wirkt dort auf die Transkription des B in
den Kern und wirkt dort auf die Transkription des
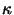 B-Motifs. Wie v-rel onkogen wird ist noch nicht geklärt. B-Motifs. Wie v-rel onkogen wird ist noch nicht geklärt.
Ein anderes Untersuchungsobjekt, der Faktor AP-1 besteht aus aus den
Untereinheiten c-fos und c-jun und aktiviert Gene und Enhancer mit
einer spezifischen Bindungsstelle. Wie die onkogene Wirkung entsteht
ist allerdings auch bei diesen Protein nicht bekannt.
Bei einem weiteren Transkriptionsfaktor, dem Schilddrüsenhormon c-erbA
erfolgt die Aktivierung der Transkription durch eine
Dimerisierung. Der Faktor v-ErbA blochiert zwar den Bindungspartner,
initiiert aber die Transkritption nicht.
fos, jun, rel und myc sind immediate early genes, die schnell
induziert werden können.
Bei den Tumorsupressorgenen sind die Gene von dem Retinoblastom Rb und
von p53 am besten charakterisiert.
Das Retinoblastom - ein Tumor in der Retina - entsteht, wenn auf
beiden Allelen das Rb-Gen deaktiviert wurde.
In ruhenden Zellen ist Rb normalerweise nicht phosphoryliert und
bindet mehrere Proteine. Diese Wirkung wird durch die
Cyklin-Cdk-abhängige Phosphorylierung am Ende von G1 aufgehoben und
die Proteine werden freigesetzt.
Da zu den Zielproteinen von Rb auch Transkriptionsfaktoren wie E2F
gehören und diese Bindung durch das Binden eines Tumorantigens an Rb
verhindert wird, kommt es zu einem Tumor. Eine Überexpression von Rb
verhindert die Zellproliferation.
Das wichtigste Tumorsupressorgen ist p53. Mutationen in diesem Gen
wirken sich dominant-negativ aus, d.h. eine Mutation in einem Allel
führt bereits zu dem mutierten Phänotyp. Ein Zelle ohne p53 wäre in
der Lage uneingeschränkt zu wachsen. Dieses Wachstum wird durch p53
unterdrückt.
Bei einer Schädigung der DNA wird p53 aktiviert und führt zu einem
Wachstumsstop oder zur Apoptose. In G1 erfolgt ein Wachstumsstop durch
den die Reparatur der DNA erfolgen kann; befindet sich die Zelle schon
in der Teilung, wird die Apoptose ausgelöst.
Die onkogene Wirkung von Substanzen beruhr häufig auf einer
Inaktivierung von p53. Wenn p53 mutiert ist, führt die zu einer
Instabilität des Genoms. Wie p53 die Apoptose auslöst ist noch
unverstanden.
An der Enstehung eines Tumors müssen immer mehrere Faktoren beteiligt
sein. Zum einen muss aus der Zelle eine permanente Zellline entstehen,
zum anderen muss sie transformiert werden, damit ein Tumor
entsteht. Auch in den meisten Viren, die Onkogene tragen findet man
zumindest Gene für zwei unterschiedliche Funktionen.
Man konnte z.B. an bereits immortalisierten Zelllinen (3T3) zeigen,
dass diese durch ras transformiert werden können. Bei nicht
immortalisierten Zellen benötigt man ras und ein weiteres Gen. Zu
dieser zweiten Gruppe gehören myc, fos, jun und E1A. Der genaue
Mechanismus der Immortalisierung ist allerdings noch
unverstanden. Zwar ist p53 ein immortalisierender Faktor, allerdings
müssen noch andere Mechanismen für die Immortalisierung verantwortlich
sein, da p53-knock-out-Mäuse lebensfähig sind.
|





