Unterabschnitte
Molekulargenetische Methoden
Restriktionsendonukleasen
Restriktionsendonukleasen werden von Bakterien als Schutz gegen viren
gebildet. Sie wirken, indem sie die Viren-DNA zerschneiden.
Diese Enzyme schneiden eine DNA-Sequenz an einer bestimmten Stelle,
die durch vier bis acht Basen definiert ist. Liegt diese Stelle im
Bakteriengenom selbst vor, sind einige der Basen methyliert.
Einige Enzyme schneiden die DNA so, dass ein DNA-Strang
überhängt. Diese Enden bezeichnet man als Klebeenden und man kann sie
dazu verwenden, um mehrere DNA-Moleküle, die mit dem gleichen Enzym
geschnitten sind, aneinander zu fügen. So erstellte DNA-Moleküle
werden als rekombinierte DNA bezeichnet.
Wenn man ein DNA-Stück mit einer bestimmten Restriktionsendonuklease
schneidet, erhält man einige in Anzahl und Länge charakteristische
Fragmente. Bei Verwendung mehrerer Restriktionsenzyme kann man eine
sogenannte Restriktionskarte einer bestimmten Region aufstellen, in
der die einzelnen Schnittstellen verzeichnet sind. Durch solche
Verfahren kann man Gene charakterisieren ohne deren Sequenz zu
kennen.
Die so erhaltenen Moleküle lassen sich in einem Agarosegel in einem
elektrischen Feld nach ihrer Grösse auftrennen.
Bei grösseren DNA-Fragmenten benutzt man die sogenannte
Pulsfeld-Gelelektrophorese, bei der sich das Feld periodisch ändert
und man so verhindert, dass sich die DNA-Moleküle in einer
schlangenförmigen Konfiguration ausrichten. Da die langen Moleküle
länger brauchen um sich im Feld auszurichten, wandern diese langsamer
und man kann auf diese Weise ganze Chromosomen von Bakterien oder
Hefen auftrennen.
Die Banden werden sichbar gemacht, indem man entweder ein radiaktives
Nukleotid in die DNA einbaut oder indem man die Banden mit
Etidiumbromid, einem im UV-Licht floureszierenden Farbstoff färbt.
Markieren von DNA
Man kann DNA auf unterschiedliche Arten markieren. Zum einen kann man
die DNA aus radioaktiv markierten Nukleotiden herstellen oder die
chemisch markieren. Diese Verfahren bieten sich an, um die DNA als
Sonde zu verwenden. Für das DNA-Footprinting oder die Sequenzierung
hängt man mittels der Polynucleotidase ein einzelnes ATP an die DNA.
DNA-Footprinting
Auch für das DNA-Footprinting wird die DNA am Ende radioaktiv markiert
und durch zufällig Spaltung oder durch Restriktionsenzyme in
Anwesenheit eines DNA-bindenden Proteins gespalten.
An der Stelle, an der das Protein an die DNA bindet kann keine
Spaltung stattfinden. Dadurch entsteht durch Vergleich der
Restriktionsmuster einer DNA mit und ohne Protein bei der Probe mit
Protein eine leere Stelle auf dem Gel - ein ,,Fussabdruck``.
Hybridisierungstechniken
Hybridisierung bezeichnet das Aneinanderlagern von zwei komplementären
DNA- oder RNA-Strängen.
Im einfachsten Fall verwendet man eine einzelsträngige DNA als
radioaktiv oder chemisch markierte Sonde. Diese gibt man in eine
Lösung mit einzelstängiger gespaltener DNA eines Chromosoms und
verdaut nach kurzer Inkubationszeit alle Einzelstrang-DNA auf diese
Weise kann man homologe Regionen isolieren.
Eine weitere Einsatzmöglichkeit der Hybridisierung ist die Analyse von
Exonsequenzen. Hierzu hybridisiert man die klonierte DNA mit der
dazugehörigen DNA. Durch einen anschliessenden Verdau mit einer
S1-Nuklease, die die Einzelstränge abbaut, kann man die nicht
hybridisierten Introns entfernen und die nach Denaturierung getrennten
Exons im Gel analysieren.
Das Northern Blotting wird häufig dazu verwendet, um Unterschiede in
einer RNA-Population zwischen einem normalen Tier und einer Mutante
festzustellen.
Hierzu wird die RNA-Population eines bestimmten Gewebes oder zwei
unterschiedlicher Mutanten aufgereinigt. Durch eine Gelelektrophorese
werden die RNA-Moleküle aufgetrennt und anschliessend durch ein
ansaugen mit einem Papierstapel auf einer Nitrozellulosemembran
aufgebracht.
Diese Membran behandelt man dann mit einer markierten DNA-Sonde, die
eine komlementäre Sequenz zu der gesuchten enthält. Diese Sonde kann
man dann durch Autoradiographie nachweisen.
Beim Southern Blot analysiert man an Stelle einer RNA-Population eine
DNA-Population.
Bei der in situ - Hybridisierung verwendet man eine DNA-Sonde, um in
der Zelle eine DNA oder RNA zu lokalisieren. Dabei markiert man die
DNA so, dass die hinterher mit einem Antikörper in der Zelle
nachgewiesen und somit lokalisiert werden kann.
Klonierung
Bei der Klonierung wird ein DNA-Fragment durch einbringen in einen
Prokaryoten - meist E. coli - vermehrt.
Plasmidvektoren, die zum Klonieren von Genen verwendet werden, sind
kleine ringförmige DNA-Moleküle. Man kann diese mit einem
Restriktionsenzym aufschneiden und eine DNA-Sequenz einbringen, die
nach der Transformation in ein geeignetes Bakterium von diesem
repliziert wird.
Wenn man für die Klonierung ein Restriktionsenzym verwendet, das keine
kohäsiven (sticky) Enden produziert kann man, z.B. durch die Terminale
Transferase einen Poly-A Schwanz an dem einen 3'-Ende und einen
Poly-T-Schwanz am anderen Ende anbringen.
Durch die Verwendung eines Expressionsvektors kann man erreichen, dass
unter der Kontrolle eines bakteriellen Promotors auch in Prokaryonten
das Eukaryonten-Gen umgesetzt wird.
Um eine DNA-Bibliothek herzustellen schneidet man das gesamte Genom
mit einem bestimmten Restriktionsenzym und stellt davon Plasmide
her. Diese bilden einen genomischen DNA-Klon, der mit den anderen
zusammen die genomische Bibliothek bildet.
Bei einer cDNA-Bibliothek verwendet man an Stelle der genomischen DNA
die zur RNA komplementäre cDNA, so dass man eine Bibliothek von
codierenden Sequenzen erhält.
Die cDNA stellt man her, indem man die RNA mit der Reversen
Transkriptase der Retroviren in DNA umschreibt und diese in Plasmid-
oder Virusvektoren einbringt. Dabei dient ein Poly-T-Nukleotid als
Primer für die RT. Der Hybrid aus RNA und DNA wird von der RNA
alkalisch befreit und durch die Polymerase I aus E. coli ergänzt.
Durch subtraktive Hybridisierung kann man selektiv bestimmte
cDNA-Klone anreichern, die in einer Zelle vorkommen, in einer anderen
hingegen nicht (vor allem bei Mutationen oder Unterschieden zwischen
Zellen).
Hierzu gibt man die mRNA der Zelle, die das gesuchte Protein nicht
exprimiert zu einer cDNA-Bibliothek einer Zellform, die das gesuchte
Gen exprimiert. Durch Fällen der RNA-/DNA-Hybride erhält man eine
aufgereinigte Form der gesuchten cDNA.
Um ein Gen aus einer Bank von transfizierten zellen zu erhalten,
bildet man zunächst einen Abklatsch der Kolonien auf einem
Filterpapier und schliesst die dort befindlichen Zellen auf. Dann kann
man mit einer Sonde die Kolonien, die das gesuchte Gen enthalten
nachweisen. Die dazugehörige Kolonie wird dannvermehrt.
Wird nicht das Gen, sonder das Protein gesucht, kann man sich
Expressionsvektoren herstellen, die in den Bakterien das Protein
produzieren. Dieses kann man dann nach der oben genannten Methode mit
Antikörpern als Sonde detektieren.
Die aus einer Bibliothek gewonnene DNA überprüft man, indem man in
vitro das Protein synthetiert und dieses nachweist.
Geht man von einer gentischen Kopplung von Genen aus, so dann man den
Ort eines Gens auf einer Kopplungskarte, wie oben beschrieben
lokalisieren.
Bei der eigentlichen Chromosomenwanderung geht man von einer bekannten
Markierung aus und stellt aus diesem Bereich eine Sonde her, mit der
man einen Klon aus einer Bibliothek fischt, der diese Sonde
enthält. Aus dem Randbereich dieses Abschnitts leitet man sich eine
weitere Sonde ab, mit der man nach dem nächsten Abschnitt fischt. So
kann man ein Chromosom in Teilabschnitte von ca. 30.000 Basenpaaren
einteilen.
Die gewonnenen Abschnitte kann man dann zum Beispiel in das Chromosom
einer Mutante integrieren und auf ihre Funktionalität hin prüfen.
Diese Abschnitte können dann in lambda-Phagen (Cosmide) eingebracht
und kloniert werden. So erhält man eine geordnete genomische
Bibliothek. Noch längere Fragmente können in den YAC's dargestellt
werden.
Mit der positionellen Klonierung hat man ein Verfahren entwickelt, das
es erlaubt, jedes beliebige Gen, das für eine Krankheit verantwortlich
ist, zu isolieren.
Der gesamte Prozess benötigt allerdings 10 bis 100 Mannjahre zur
Lokalisierung eines einzelnen Gens.
Die Methode beginnt mit einem Stück der genomischen DNA, die sich
zwischen zwei RFLP-Markern befindet, die mit dem Merkmal zusammen
vererbt werden. Von diesem Bereich wird eine geordnete genomische
Bibliothek erstellt, in der dann die in der Maus konsverierten
Sequenzen durch Hybridisierung festgestellt werden. Die entsprechenden
Sequenzen werden dann daraufhin untersucht, ob sie für eine bestimmte
DNA in dem Zielgewebe codieren. Unter den Sequenzen für die dies der
Fall ist, wird dann diese ausgewählt, die bei den Personen mit einem
mutanten Phänotyp von den anderen abweicht.
Polymerase-Kettenreaktion (PCR)
Mit der PCR ist es möglich, ein bestimmtes Fragment in beliebiger
Häufigkeit zu amplifizieren.
Dabei geht man so vor, dass eine Doppelstrang-DNA zuerst durch
erhitzen getrennt wird, dann hat man spezifische Primer zugegeben, die
an den Enden der Sequenz binden. An diesen Primern kann dann eine
Polymerase angreifen (meist aus einem thermophilen Bakterium Thermus
aquaticus - Taq), die dann die Einzelstränge zu Doppelsträngen
ergänzt. Diese werden dann im nächsten Schritt wieder aufgetrennt und
der Zyklus beginnt von vorne.
Auf diese weise amplifiziert man eine DNA exponentiell.
Dadurch kann man auch winzige Mengen DNA (oder RNA durch Verwendung
der Reversen Transkriptase) amplifizieren und nachweisen. So kann man
Erbkrankheiten nachweisen oder in der Kriminalistik einen genetischen
Fingerabruck erstellen.
DNA-Manipulation
Durch die PCR ist es möglich, bestimmte DNA-Abschnitte gezielt zu
vervielfältigen und die Enden so zu modifizieren, dass man die Sequenz
in einen Vektor einbringen kann.
Durch in vitro-Transkription kann man auf relativ einfache Art und
Weise aus einer DNA grosse Mengen RNA herstellen.
Bringt man die Information eines Proteins in einem Exptrssionsvektor
under, so kann man diese in beliebieger Menge in einem Bakterium
synthetisieren.
Die Transkription eines Gens wird von regulatorischen Einheiten der
DNA kontrolliert. Diese lassen sich mit Reportergenen untersuchen. Bei
einem solchen Verfahren wird die Information des eigentliche Proteins
durch die Sequenz eines anderen leicht nachweisbaren Proteins
ersetzt. Die Expression eines solchen Gen, wie zum Beispiel der
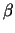 -Galactosidase kann dann durch eine Farbreaktion zeitlich wie
räumlich festgestellt werden. -Galactosidase kann dann durch eine Farbreaktion zeitlich wie
räumlich festgestellt werden.
Mutante Organsimen
Die Funktion eines bestimmten Proteins kann man am besten bei Mutanten
untersuchen. Die Mutanten, die ein Protein nicht bilden könnnen zeigen
normalerweise durch die Defekte seht gut, welche Funktionen das
Protein normalerweise erfüllt.
Gerade bei Tieren mit kurzen Vermehrungszyklen kann man deren DNA
durch Mutagene gezielt zu Mutationen anregen. Dann sortiert man
gezielt die interessanten Mutanten aus.
Bei menschlichen Zellen kann man vor allem mit Zellkulturen
arbeiten. hier arbeitet man vor allem mit genetischen Methoden,
mittels derer man gezielt Mutanten eines bestimmten Gens
hervorruft. Bringt man mutierte Gene in eine fremde Zelle ein, so
spricht man von Reverser Genetik. Dieses Verfahren führt, wenn die
Zielzelle eine Eizelle ist, zu einem transgenen Organismus.
Um die Funktion eines Proteins genauer zu untersuchen, stellt man
entweder über die PCR gezielte Mutationen her (über einen Primer
eingeführt) oder man stellt Fusionsproteine her, die die
Lokalisationssequenz des zu untersuchenden Proteins, fusioniert mit
einem Reportergen enthält, welches man dann in der Zelle leicht
nachweisen kann. Ist dies nicht möglich, kann man auch die Technik der
Epitopmarkierung verwenden, bei der an das eigentliche Protein nur ein
kurzes Peptid von einigen Aminosäuren angebracht wird, welches man
dann mit einem Antikörper nachweisen kann.
Bei vielen niederen Eukaryonten und Prokaryonten kann man ein Gen
einfach dadurch ersetzen, indem man das mutierte Gen in die Zelle
einführt und das dort das intakte Gen durch gene replacement mittels
homologe Rekombination ersetzt.
Bei höheren, diploiden Organismen führt das Einführen einer mutierten
DNA dazu, dass diese zusätzlich in das Genom integriert wird. Bringt
man zusätzlich antisens-RNA gegen die ursprüngliche RNA in die Zelle
ein, so kann man die Translation des gesungen Proteins verhindern.
Ist das Protein für die Zelle lethal, so kann man es mit einer
Kontrollsequenz verbinden, die es erlaubt, das Gen gezielt zu
aktivieren (induzierbar).
Obwohl sich die fremde DNA normalerweise beliebig in das Genom
der Säuger integriert, kann sie in einem unter 1.000 Fällen das
homologe Gen ersetzen.
Für dieses Verfahren wird das mutierte Gen in einen Vektor integriert
und in embryonale Stammzellen (ES-Zellen) der Maus
eingebracht. Diese Zellen lässt man dann in Kultur wachsen und
selektiert die Zellen, in denen das Gen ersetzt wurde, indem man einen
weiteren Marker auf dem Vektor anbringt, der in den Zellen eine
Sensitivität gegen eine bestimmte Substanz einbringt. Dieser Marker
wird bei einer homologen Rekombination nicht miteingebaut - wohl aber
bei einer willkürlichen Integration.
Diese Stammzellen bringt man dann in einen Embryo ein. Ein grosser
Teil der Zellen des Embryos werden dann von der mutierten Zelle
abstammen. Wenn man Glück hat, dann sind dabei auch Zellen der
Keimbahn betroffen und man kann durch Züchtung eine homozygote
Knock-out-Maus erzeugen.
Bei Pflanzen lassen sich auf einzelnen Zellen auf geeignetem
Nährmedium Kallusgewebe züchten, welches man dann teilen und zur
Produktion vieler identischer Pflanzen nutzen kann.
|





