Unterabschnitte
Proteine
Die Funktion eines Proteins wird durch seine Sequenz und seine
Postitionsinformation festgelegt.
Die Proteine werden, wie viele andere Moleküle in der Zelle, aus
einfachen Bausteinen zusammengesetzt. Die Bildung der Polymere wird
Kondensation, deren Aufbrechen Hydrolyse genannt. Bei Proteinen
spricht man von einer proteolytischen Reaktion.
Praktisch alle biologischen Polymere bestehen aus einem Rückgrat und
funktionalen Seitengruppen. Bei den Proteinen wird das Rückgrat durch
eine Reihe von Peptidbindungen zwischen einer NH2- und einer
COOH-Gruppe gebildet, während die Aminosäure-Reste die Seitengruppen
darstellen. Die so entstehenden Einheiten werden Polypeptide genannt
und bilden als Funktionelle Einheit ein Protein.
Das Ende, an dem sich eine freie NH2-Gruppe befindet, wird
Aminoterminales, das andere Carboxyterminales Ende genannt.
Die Aminosäuren unterteilt man in:
- Basische AS, die an eine freie NH2-Gruppe ein Proton
anlagern können.
- Saure AS, die eine Carbonsäure tragen (COOH) und ein
Proton abgeben können.
- Neutrale, polare AS, die eine Ladung tragen.
- Neutrale, hydrophobe AS, die hydrophob sind und dazu
neigen, mit anderen Gruppen zu interagieren.
Das Prolin verursacht einen Knick in der Kette. Neben dieser
Einteilung können die AS auch nach ihrem Einbau in das Protein noch
wesentlich verändert werden: Am häufigsten findet man eine
Phosphorylierung, das heisst, das Anhängen einer Phosphatgruppe an ein
Serin,Tyrosin oder Threonin, sowie die Anlagerung von Acetyl- oder
Methyl-Gruppen, also eine Acetylierung oder Methylierung.
Bei Glykoproteinen sind Zucker an das Protein geknüpft. Diese können
N-gekoppelt sein und an ein Asparagin gebunden sein oder sie sind
O-gekoppelt und mit der Hydroxylgruppe von Serin oder Threonin
verbunden.
Proteinkonformation und -faltung
Die Proteine bilen ihre Struktur vor allem durch Wechselwirkungen im
polaren Milieu, ausserdem findet man - vor allem bei sezernierten und
Oberflächenproteinen - auch Disulfidbrücken.
Die Struktur wird in folgende Ebenen gegliedert:
- Die Primärstruktur eines Proteins ist die Sequenz der
Aminosäuren.
- Die Sekundärstruktur von
 -Helices und -Helices und
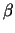 -Faltblättern bildet sich automatisch. Kombinationenen aus
Faltblättern und Helices bilden sogenannte Domänen aus.
Die Sekundärstruktur entspricht dem Verlauf des Rückgrats. -Faltblättern bildet sich automatisch. Kombinationenen aus
Faltblättern und Helices bilden sogenannte Domänen aus.
Die Sekundärstruktur entspricht dem Verlauf des Rückgrats.
- Die Tertiärstruktur ist die dreidimensionale Anordnung
des Proteins.
- Die Quatermärstrukturen bilden sich durch die Bildung
von Dimeren oder Oligomeren.
Die Aminosäuren können über Disulfidbrücken zwischen zwei
Cysteinresten entstehen; der Hauptantrieb der Faltung ist jedoch das
Auftreten von schwachen Wechselwirkungen (um den Faktor 10 schwächer
als eine kovalente Bindung):
- Wasserstoffbrückenbindungen
- van der Waals-Kräfte
- Ionenbindungen
- hydrophobe Wechselwirkungen
In einem Protein könne sich durch diese Seitengruppen zwei Arten von
Oberflächen ausbilden: Hydrophobe und Hydrophile.
Die zwei strukturgebenden Motive der Proteine sind die  -Helix
und das -Helix
und das 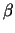 -Faltblatt. Die -Faltblatt. Die 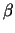 -Faltblattstrukturen findet man
vor allem im Kern der meisten Proteine. Die -Faltblattstrukturen findet man
vor allem im Kern der meisten Proteine. Die 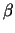 -Faltblätter bilden
dort eine Stützkonstruktion für die übrige Struktur. -Faltblätter bilden
dort eine Stützkonstruktion für die übrige Struktur.
Die Helices bilden sich durch Wasserstoffbrücken zwischen der C=O und
der NH-Gruppe mit jeweils vier Aminosäuren Abstand.
Die Faltblätter bilden sich in Abwesenheit von Alanin und Glycin durch
das Aneinanderlagern von mehreren Ketten. Sie ist die am häufigsten
vorkommende Komponente.
Mehrere  -Helices können sich zu coiled coil -
Doppelwechselstrukturen zusammenlagern und sind so auch in wässrigen
Milieu aktiv. -Helices können sich zu coiled coil -
Doppelwechselstrukturen zusammenlagern und sind so auch in wässrigen
Milieu aktiv.
Das 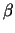 -Faltblatt entsteht durch die Wechselwirkung zwischen einer
C=O-Gruppe einer und einer NH-Gruppe einer anderen Peptidbindung. -Faltblatt entsteht durch die Wechselwirkung zwischen einer
C=O-Gruppe einer und einer NH-Gruppe einer anderen Peptidbindung.
In einem bestimmten Bereich des Protein befinden sich AS, deren
Seitengruppen einen spezifischen Liganden erkennen können; dieser
Berecih wird das Aktive Zentrum genannt und spielt bei der Aktivität
des Proteins eine entscheidende Rolle.
Ein Protein kann eine beliebig hohe Anzahl von Konformationen
annehmen. Die Faltung der ,,richtigen`` Struktur beginnt noch
während der Proteinsynthese.
Die Primärstruktur enthält alle Informationen zur Bildung der
Sekundärstruktur. Ein weiteres Einwirken anderer Proteine ist nicht
notwendig. Man kann dies durch Denaturieren von Proteinen in vitro
zeigen: Diese renaturieren wieder. Diesen Mechanismus findet man
klassisch bei der Ribonuklease.
Damit ein Protein die richtige Konformation (Tertiärstruktur)
einnimmt, sind teilweise Cofaktoren oder Untereinheiten erforderlich.
Dies können entweder eine stöchiometrische Wirkung haben (Chaperone
verhindern durch ihre Anlagerung eine falsche Faltung) oder sie haben
eine katalytische Wirkung, indem sie Disulfidbrücken bilden
(z.B. Proteindisulfidisomerase) oder eine Bindungsänderung von cis
nach trans durchführen (Peptidylpropylisomerase).
Eine Modifikation der Aminosäuren kann ebenfalls die Konformation
ändern. Diese Modifikationen können Phosphorylierungen,
Methylierungen, Acetylierungen oder Glycosylierungen sein.
In einigen Fällen kann die korrekte Faltung auch nur während der
Synthese stattfinden.
Die eigentliche Faltung wird in den meisten Fällen unter der Kontrolle
molekularer Chaperone durchgeführt. Die Chaperone sind mit den
Hitzeschockproteinen verwandt und helfen den Proteinen aktiv bei der
Proteinfalung oder verändern deren Struktur, wenn sie sich zunächst
falsch gefaltet haben.
Sie binden selektiv an Bereiche, die nur bei einer falschen Faltung
oder während der Synthese offen liegen.
Eine weitere wichtige Rolle spielen die Chaperone bei dem Tranport von
Proteinen durch Membranen; hier halten sie die Proteine in einem
ungefalteten Zustand und helfen hinterher bei der korrekten Faltung.
Ein Protein ist in sogenannte Domänen unterteilt. Diese können in der
Evolution konservierte Einheiten sein oder aber es sind
Funktionseinheiten, die eine spezielle Aufgabe wahrnehmen.
Allosterische Proteine können ihre Konformation wechseln. Das
auslösende Signal für diesen Wechsel ist häufig die Bindung eines
Cofaktors.
|





