Unterabschnitte
Zellkompartimente
Die Kompartimente der Zelle vergrössern die Membranoberfläche und
schaffen vom Cytoplasma abgeschlossene Reaktionsräume.
Der grösste Raum dieser Art ist das ER. Das ER ist an seiner
cytoplasmatischen Seite mit Ribosomen bedeckt, die membranegebundene
und sezernierte Proteine synthetisieren. Des weiteren synthetisiert
das ER Lipide und dient der Zelle als Calciumspeicher.
Der Golgiapparat besteht aus einem Stapel von Kompartimenten, die als
Golgi-Zisternen bezeichnet werden.
Weitere abgegrenzte Bereiche sind die Chloroplasten, Mitochondrien,
die Lysosomen, die Endosomen und die Peroxisomen.
Die Anordnung der Kompartimente zueinander wird durch die Mikrotubuli
gewährleistet.
Die Kompartimentierung ist eine Anpassung an das Wachstum der
Zelle. Dadurch, dass die Zellen der Eukaryoten im Verhältnis zu den
Bakterien wesentlich gewachsen sind, mussten sie eine Strategie der
Oberflächenvergrösserung finden.
Mit der Zeit haben sich ausserdem sehr wahrscheinlich Membranbereiche
immer mehr spezialisiert, organisiert und mit der Zeit kam es dann zu
Einstülpungen der Membran, die sich mit der Zeit abgeschnürt haben und
dann einen isolierten Reaktionsraum bildeten.
Die Membraneigenschaften der Membranen von ER, Golgi und vielen der
Transportvesikel kann man immer noch ihre Herkunft von einer
Einstülpung der Membran her ansehen. Diese Kopartimente weisen auf
ihrer Aussenseite eine Sturktur auf, die der Innenseite der
Plasmamembran bei einigen unkompartimentierten Bakterien ähnelt,
während die Innenseite eher der nach Extrazellulär orientierten Seite
der Membran ähnelt.
Die Mitochondrien und Chloroplasten, die nach der
Endosymbiontentheorie ehemals eigenständige Bakterien waren und dann
in die Zelle eingewandert sind, sind von einer doppelten Membran
umgeben und sind von den intrazellulären Transportprozessen
ausgeschlossen.
Vom entwicklungsgeschichtlichen Standpunkt her kann man die
intrazellulären Kompartimente wie folgt unterteilen:
- Kern und Cytosol durch die Kernporen verbunden
- Organellen des sekretorischen und endozytotischen Transportwegs
(ER, Golgi, Endosomen, Lysosomen)
- Mitochondrien
- Plastide (in Pflanzenzellen)
- Peroxisomen
Proteintransport zwischen Kompartimenten
Alle Proteine werden im Cytosol synthetisiert und entsprechen einem
Sortiersignal in der Aminosäurekette in eines der Kompartimente
transportiert.
Bei dem Transport von Proteinen zwischen zwei Kompartimenten gibt es
unterschiedliche Mechanismen:
![\begin{entry}
\item [Schleusen-Transport] \mbox{} \\
Beim Schleusen-Transport...
...spung abgeschnürt und als Vesikel zur
Zielorganelle transportiert.
\end{entry}](img7.png)
Der Zielort eines Proteins wird durch sein Signalpeptid oder einen
Signalbereich bestimmt.
Bei dem Signalpeptid handelt es sich um eine spezifische Sequenz von
einer Länge von 15 bis 60 Aminosäuren. Dieser Bereich wird am Zielort
in einigen Fällen von der Signalpeptidase wieder entfernt.
Signalbereiche liegen indes nicht am Rand der Aminosäuresequenz,
sondern werden aus mehreren Bereichen des Proteins gebildet, die
teilweise auf der Sequenz weit voneinander entfernt liegen können.
Die Zelle ist nicht in der Lage, ihre Kompartimente de novo zu
synthetisieren, denn die Proteine des ER werden vom ER
produziert. Somit ist immer eine Weitergabe der Kompartimente an die
Tochterzellen notwendig.
Kerntransport
Der Kern ist von zwei ineinander übergehenden Membranen umgeben. Die
beiden Membranen weisen unterschiedliche Eigenschaften auf: Die
innnere Membran besitzt Anheftungsstellen für die Kernlamina, während
die äussere Hülle dem ER ähnelt und auch der Proteinbiosynthese
dient.
Die Kernmembran wird von Kernporen, die von einem Kernporenkomplex
gebildet werden, durchbrochen.
Kleine Moleküle unterhalb von 60 kDalton können die Poren durch
Diffusion durchqueren; für grössere Proteine ist ein aktiver Transport
in den Kern notwendig:
Welche Proteine in den Kern transportiert werden bestimmt die
Kernlokalisierungssequenz, eine kurze Sequenz von vier bis acht
überwiegend positiv geladenen Aminosäuren, die zumeist ein Prolin
enthalten. Diese Sequenz kann an beliebiger Stelle im Protein
lokalisiert sein und ist bei einigen Proteinen in zwei durch bis zu 10
Aminosäuren getrennten Bereiche aufgeteilt.
Es spielt keine Rolle, an welcher Stelle der Aminosäuresequenz sich
die Kernlokalisierungssequenz befindet.
Wird die Kernlokalisierungssequenz phosphoryliert, wird das Protein
nicht in den Kern transportiert; so kann dessen Aktivität im Kern
geregelt werden.
Der Eintransport in den Kern beginnt mit der Bindung von Proteinen aus
dem Cytoplasma, die eine Interaktion mit der Kernpore
herbeiführen. Die zu importierenden Proteine binden zuerst an die
Firbrillen am Rand der Kernpore und werden dann in dessen Zentrum
gebracht. Durch einen ATP-verbrauchenden Prozess werden die Proteine
dann in den Kern importiert, wobei sich die Kernpore vergleichbar
einer Kamerablende öffnet und das Protein durch eine wässrige Pore in
den Kern transportiert. Die Poren sind auch für den Transport aus dem
Kern heraus verantwortlich.
Die Transportprozesse am Zellkern konnte man mit der Hilfe von
Goldkörnern, die mit einer Kerlokalisierungssequenz verbunden waren
nachweisen.
Die RNA wird durch ihre Bindung an das Spleissosom am Verlassen des
Kerns bevor die vollständig verarbeitet ist, gehindert. Nur die RNA,
die ein Cap am 5'-Ende besitzt und nicht mehr mit dem Spleissapparat
verbunden ist, kann den Kern verlassen.
Zu Beginn der Mitose wird die Kernlamina phosphoryliert, was ihre
Interaktion mit dem Chromation verhindert und zur Depolymerisation
führt. Dadurch, dass sie sich auflöst, zerfallen auch die
Kernporenkomlexe in ihre Bestandteile, die Kernmembran teilt sich in
Vesikel und alle Elemente verteilen sich über die Zelle.
Wenn dann die Zellteilung vorüber ist wird das Laminin wieder
dephosphoryliert und verbindet sich so mit dem Chromatin. So bilden
sich enge Membrankomplexe um die Chromosomen herum. Nachdem sich dann
auch die Kernporenkomplexe wieder gebildet haben, beginnt der erneute
Import von Kernproteinen. Aus diesem Grund wird die
Kernlokalisierungssequenz nicht entfernt - sie wird bei jeder
Zellteilung wieder benötigt.
Transport in Mitochondrien und Chloroplasten
Die Mitochondrien sind aus zwei Membranen, die einen sogenannten
Matrixtraum umgeben aufgebaut. In diesem Matrixtraum befindet sich bei
den Chloroplasten ein weiterer durch die Thylakoidmembran abgetrennter
Thylakoidraum.
Da die Mitochondiren und Chloroplasten selbst nur einen sehr
begrenzten Satz von Proteinen herstellen und dies häufig auch nur
Untereinheiten anderer Proteine, die im Cytosol synthetisiert werden
sind, müssen die Proteine aus dem Cytosol durch eine oder mehrere
Membranen transportiert werden.
Proteine, die für einen Import in die Mitochondrien vorgesehen sind,
sind mit einer bestimmten Signalsequenz versehen. Sie haben eine
Sequenz von meist 20-80 Amimosäuren, die eine alipathische
 -Helix bilden, auf deren einen Seite sich hydrophobe und auf
deren anderer Seite sich polare Gruppen befinden. -Helix bilden, auf deren einen Seite sich hydrophobe und auf
deren anderer Seite sich polare Gruppen befinden.
Diese Sequenz wird erkannt und in das Mitochondrium importiert. Für
diesen Prozess ist neben dem ATP der elektrochemische Gradient der
Mitochondrienmembran die Triebfeder.
In einem ersten Schritt bindet das Protein auf Grund des
elektrochemischen Gradienten an die Membran und wird dann zu einer
anderen Stelle transportiert, von wo aus dann der Import unter
ATP-Verbrauch erfolgt.
Da die Proteine nicht in ihrem gefalteten Zustand in das Mitochondrium
importiert werden können, werden sie im Cytosplasma von Hsp70 in einem
ungefalteten Zustand gehalten. In diesem Zustand werden die Proteine
importiert. Im Matrixtraum des Mitochondriums bindet dann das
mitochondriale Hsp70 an das Protein. Man nimmt an, dass diese Bindung
und das Anschliessende Lösen des Hsp70 den Import vorantreibt. Ohne
dieses Protein findet kein Import statt.
Dann wird das entfaltete Protein von dem mitochondrialen Hsp60 in
seine entgültige Konformation gebracht.
Um Proteine in den Raum zwischen die Innen- und die Aussenmembran zu
befördern, gibt es zwei Möglichkeiten.
Zum einen kann sich an dem bereits in der Matrix befindlichen Protein
nachdem das Signalpeptid abgespalten wurde, hinter diesem ein weiteres
Signal befinden, das das Protein in die Innenmenbran zurückbringt und
dann in den Raum zwischen die Membranen schleust.
Ein anderer Weg wäre der Stop des Proteintransportes an der inneren
Membran auf ein bestimmtes Signal hin. Dann würde sich das
Translokationsprotein der inneren Membran lösen und das sich nun im
Membranzwischenraum befindliche Protein durch Spaltung der
Signalsequenz freisetzen.
Bei den chloroplasten erfolgt der Import in den Thylakoidraum
ebenfalls in zwei Schritten: Zuerst wird das Protein in den Matrixraum
transportiert, wo seine Signalsequenz abgespalten wird. Hinter dieser
ersten Signalsequenz sitzt eine zweite Sequenz, die dann den Import in
den Thylakoidraum steuert.
Peroxisomentransport
Peroxisomen enthalten kein eigenes Genom und enthalten vor allem
oxidierende Enzyme wie Katalase und Urat-Oxidase. Man nimmt an, das
diesen Organellen in früherer Zeit einmal die Rolle zukam, den
schädlichen Sauerstoffgehalt der Zelle zu senken und dabei die
freiwerdende Energie zu nutzen.
In den Peroxisomen entsteht in einem ersten Schritt Wasserstoffperoxid
durch die Oxidation von organischen substanzen:
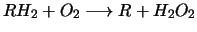
Das Wasserstoffperoxid wird dann von der Katalase benutzt, um weitere
Substanzen zu oxidieren:
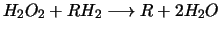
Insbesonder in Niere und Leber werden so giftige Substanzen, wie
Ethanol, abgebaut. Ausserdem bauen die Peroxisomen Fettsäuren zu
AcetylCoA ab, welches dann in anderen Stoffwechselprozessen weiter
verwendet werden kann.
Vor allem in der Pflanzlichen Zelle spielen zwei Typen von Peroxisomen
eine wichtige Rolle. Als Glyoxisomen im Samen dienen die dem Fettabbau
und in den Blättern oxidieren sie ein Nebenprodukt der Photosynthese,
was Photorespiration genannt wird.
Der Import von Proteinen in die Peroxisomen wird von einer 3
Aminosäuren langen Sequenz gesteuert. Der genaue Mechanismus scheint
dem des ER zu ähneln ist im Detail aber noch nicht geklärt.
Endoplamatisches Retikulum
Das Endoplasmatische Retikulum (ER) ist mit Ribosomen bedeckt und
synthesiert Proteine, die dann entsprechend ihrer Signalsequenz
sortiert werden und über das Golgi-Netzwerk z.B. zur Zellmembran
transportiert werden.
Das ER nimmt oft bis zu 10% des Zellvolumens ein. Dieser Raum wird
als ER-Lumen bezeichnet.
Man unterscheidet das glatte ER ohne Ribosomen von dem mit Ribosomen
bedeckten rauhen ER.
Das glatte ER ist in den meisten Zellen nur in Form eines Übergangs-ER
vorhanden. Dies sind kurze Abschnitte des ER, an denen sich keine
Ribosomen befinden und an denen sich Transportvesikel abschnüren. Bei
Zellen, die zu einer hohen sekretorischen Tätigkeit angeregt werden,
kann das Volumen des ER innerhalb einer relativ kurzen Zeit sehr
zunehmen. Ausserdem findet man in Muskelzellen eine spezialisierte
Form des ER, da sarkoplasmatische Retikulum, ein glattes ER, das in
erster Linie als Calciumspeicher dient.
Um das ER zu untersuchen, kann man durch Zentrifugation aus einem
Zellhomogenat sogenannte Mikrosomen, kleine Vesikel, die funktional
dem ER entsprechen, abtrennen. Diese kann man dann in vitro
untersuchen.
Wenn ein Ribosom an der Synthese eines Proteins für das ER beteilig
ist, wird es von diesem dort hin dirigiert und das Protein wird dann
co-tranlational, d.h. während der Translation in das ER importiert.
Ein Singalpeptid dient als Erkennungssignal für den Transport zum
ER. Neben diesen Signal sind an dem Prozess ein signal-recognition
particle (SRP) und ein SRP-Rezeptor beteiligt.
Der SRP ist ein kleiner Partikel, bestehend aus sechs
Polypeptidketten, die alle an eine RNA gebunden sind. Sobald sich das
Signalpeptid am (noch freien) Ribosom gebildet hat, bindet dort der
SRP. Diese Bindung stoppt die Translation bis der Komplex an den
SRP-Rezeptor, der sich an der cytosolischen Seite der ER-Membran
befindet, bindet. Dann löst sich der SRP von dem Komplex und die
Translation geht weiter, wobei das Protein direkt in das ER-Lumen
importiert wird.
Der Import geschieht durch eine wässrige Pore, die von einem
Proteintranslokator gebildet wird. Nach dem Import des Proteins
verbleibt das Signalpeptid zumeist in der Membran und wird dann von
einer Signal-Peptidase abgespalten, so dass das Protein in das
ER-Lumen freigesetzt wird.
Bei Membrangebundenen Proteinen ist der Prozess etwas schwieriger, da
diese nur zum Teil translokiert werden müssen:
Im einfachsten Fall wird die Translokation von dem Signalpeptid - in
diesem Zusammenhang auch Start-Transfer-Peptid genannt - gestartet
und von einer Sequenz im Inneren der Peptidkette - der
Stop-Peptid-Sequenz - gestoppt.
Eine andere Möglichkeit ist die, dass das Signalpeptid nicht am
aminoterminalen Ende liegt, sondern im Inneren der Sequenz. Auch hier
bindet der SRP und transportiert das Protein zum ER. In diesem
Fall gibt es dann wiederum zwei Möglichkeiten, wie die Sequenz in die
Membran eingefügt werden kann. Sie kann entweder so eingefügt werden,
dass das aminoterminale oder so dass das carboxyterminale Ende in das
ER-Lumen ragt.
Noch komplizierter gestaltet sich der Prozess bei Proteinen, die
mehrere Transemembrandomänen besitzen. Hier dienen mehrere hydrophobe
Domänen als Start- und Stop-Signale, was dazu führt, dass ein Protein
dei Membran mehrfach durchspannt. Durch diesen Mechanismus kommt es zu
der assymetrischen Ausrichtung der Proteine in der Membran.
Je nach ihrer späteren Bestimmung verbleiben die Proteine dann in der
Membran als Transmembranmoleküle oder sie wurden in das Lumen
freigesetzt.
Bei den letzteren entscheidet das Vorhandensein eines
ER-Retentions-Signals aus vier Aminosäuren am Carboxyterminus darüber,
ob diese im ER-Lumen bleiben oder weiter transportiert werden. Viele
der im ER verbleibenden Proteine sind entweder - wie z.B. das
Bindeprotein BiP - den Chaperonen zuzuordnen und helfen den Proteinen
im ER bei der Faltung, oder aber sie helfen bei der Bildung bestimmter
Strukturen, da die z.B. wie die Protein-Disulfid-Isomerase
Disulfidbrücken an den später extrazellulär liegenden Domänen
ausbilden.
Ausserdem werden die meisten Proteine des ER glykosyliert. Am
häufigsten wird ein vorgefertigter Oligosaccharidkomplex auf einen
Asparagin-Rest des Proteins übertragen. Diese Aufgabe wird von der
Oligosaccharyl-Transferase katalysiert. Der vorgefertigte
Oligosaccharid wird von einem spezifischen Protein, dem Dolichol in
der Membran festgehalten und dann durch die Einwirkung der
Oligosaccharyl-Transferase auf das Protein übertragen. Die
Aktivierungsenergie kommt dabei aus einer Phosphatbindung zwischen den
Dichol und dem Oligosaccharid.
Sehr wahrscheinlich kommen alle anderen Oligosaccharide durch eine
Modifikation dieses einen Vorläufers zu Stande.
Bei einigen Proteinen wird das carboxyterminale Ende gegen einen
Glykosylphosphatidylinositol-Anke (GPI-Anker) ausgetauscht. Dieser
verankert das Protein in der Membran und führt dazu, dass es durch
eine Phospholipase, die den Anker spaltet, freigesetzt werden kann.
Auch die meisten Lipidschichten der Zelle werden im ER
synthetisiert. Das wichtigste Lipid ist das Phosphatidylcholin
(Lecithin), das über drei Schritte aus zwei Fettsäuren gebildet wird.
Diese Synthese findet ausschliesslich an der cytosolischen Seite des
ER statt, so dass ein Phospholipid-Tranferase oder Flippase die neu
gebildeten Lipide zur anderen Seite der Membran transportieren muss.
Auch Cholesterol und Ceramid, ein Vorläufer für den Aufbau der
Glykolipide, werden im ER synthetisiert.
Die neu gebildeten Phospholipide werden dann von spezifischen
Phospholipid-Austauschproteinen aus der Membran des ER extrahiert und
durch Diffusion zu anderen Membranen (z.B. Mitochondirienmembran)
gebracht und dort eingebaut.
Golgiapparat
Der Golgi-Apparat besteht gewöhnlich auch einer Reihe von
Golgi-Stapeln, die wiederum vier bis sechs Zisternen enthalten.
Beim Golgi-Netzwerk wird die dem ER zugewande Seite als cis- oder
Bildungs- und die andere Seite als trans- oder Reigungs-Seite
bezeichnet.
Wenn ein im ER synthetisiertes Protein kein Singal trägt, das es im ER
oder Golgi zurückhält oder an eines der anderen Kompartimente, wie
Lysosomen weiterleit, wird es auf dem ``default path`` über
das Golgi-Netzwerk zur Membran transportiert.
Werden Proteine, die ein ER-Rückhaltesignal haben in den Golgi-Apparat
transportiert, so werden sie erkannt, vom cis-Golgi-Netzwerk
abgeschnürt und zurück zum ER transportiert.
Die im ER an bestimmte Proteine angefügten N-bündigen Oligosaccharide
(an der NH2-Gruppe eines Asparagins angefügt) werden im Golgiapparat
nochmals modifiziert.
Bestimmte Mannose-reiche Oligosaccharide werden in Abhängigkeit von
der sterischen Behinderung im Golgiapparat weiter modifiziert. Dadurch
entstehen die komplexen Oligosaccharide, die weniger Mannose enthalten
und an die dann mehrere andere Zicker angefügt werden.
Die Modifikation der Oligosaccharide verläuft von der einen Seite des
Golgi-Apparates zur anderen in mehreren Schritten ab, wobei jeder
Schritt in einem eigenen Stapel abläuft.
Neben der Modifikation der N-Glykosylierung werden auch an bestimmte
OH-Gruppen von Serin oder Threonin Zucker angeheftet. Dabei spricht
man von einer O-Glykosylierung.
Die Proteoglykan-Kernproteine sind die am stärksten glykosylierten
Proteine überhaupt. Sie sind Hauptbestandteil der extrazellulären
Matrix und werden im Golgi-Netzwerk zu Proteoglykanen umgebaut.
Da all diese Modifikationen an der Innensteie der ER- und Golgimembran
ablaufen, sind die entsprechenden Zucker hinterher nach aussen
ausgerichtet.
Die genaue Funktion der Glykoproteine ist noch nicht sicher. Man hat
allerdings festgestellt, dass glykosylierte Proteine sehr
widerstandsfähig gegenüber Proteasen sind und vermutet, da man solche
Modifikationen bei Bakterien nicht findet, dass die Glykosylierung bei
den Ur-Eukaryonten einen Schutzmechanismus dargestellt hat, der
deutlich flexibler als die Membran der Baktieren war.
Vesikeltransport
Alle Proteine, die den trans-Golgi-Apparat durchlaufen haben werden zu
Vesikeln geformt und entweder als sekretorische Vesikel an die
Zelloberfläche oder an die Lysosomen weiter gereicht.
Wenn sich ein Transfportvesikel abschnürt, ist es zumeist mit eine
Substanz bedeckt (coated).
Man kann zwei Arten von coated vesicles unterscheiden. Die Clathrin
coated vesicles sind mit Clathrin bedeckt und vermitteln einen
spezifischen Transport von membrangebundenen Proteinen und befördern
Flüssigkeiten, während die coatamer coated vesicles einen
unspezifischen Transport vermitteln.
Über eine eventuelle dritte Klasse, die Calveolen ist noch nichts
bekannt.
Das Clathrin bildet eine ,,Mercedes-Stern``- Struktur aus,
dies es ihm ermöglicht, mit meheren Molekülen Clathrin einen
wabenartigen Käfig um ein Membranvesikel herum aufzubauen. Dieser
Käfig löst sich relativ schnell, sobald sich das Vesikel von der
Donor-Membran gelöst hat. Man vermutet, dass dies evetuell durch
eine calciumabhängig Aktivierung von Chaperonen geschieht.
Dieser Clathrinbelag ist erfüllt zwei Aufgaben: Er hilft beim
Einfangen der Rezeptoren und liefert die mechanische Kraft zum
Abschnüren des Vesikels. Die Rezeptoren werden durch ein speziellen
Molekül, das Adaptin, gebunden. An diesem kann dann wiederum das
Clathrin binden. So benötigt man nur einen Clathrintyp - hat aber
mehrere Adaptine.
Die coatomer coated vesicles bilden sich nicht freiwillig, sondern
benötigen für ihre Bildung GTP und ein ARF genanntes Protein. Die sich
dann gebildeten Coats lösen sich von dem Vesikel erst nachdem es sein
Ziel erreicht hat und bilden die Basis des unspezifischen Transports.
Die Regulation durch ARF erfolgt sehr wahrscheinlich dadurch, dass
dieses G-Protein einen Fettsäureschwanz besitzt, mit dem es sich in
seiner GTP-gebundenen Form an die Membran binden kann. Dann bindet es
den Coatomer und das Vesikel wird zur Zielmembran transportiert. Dort
hydrolysiert das ARF sein GTP zu GDP und löst sich von der
Membran. Der Coat zerfällt und das Vesikel verschmilzt mit der
Membran.
Man nimmt an, dass das Anheften der Vesikel an die Membran von den
sogenannten rab-Proteinen, kleinen GTPasen katalysiert wird. Diese
sind an die Membran des Vesikeln in ihrer GTP-gebunden Form gebunden.
Wenn nun eine Bindung zwischen t-SNARE und v-SNARE zustande kommt,
dann führt dies dazu, dass das GTP hydrolysiert wird und das Vesikel
somit an die Membran angeheftet wird.
Die Fusion mit der Zielmembran erfordert, dass Wasser von der
hydrophilen Oberfläche verdrängt wird. Da dies ein energetisch
ungünstiger Prozess ist, muss er von einem Proteinkomplex vermittelt
werden. Man nimmt an, dass dabei die Proteinkomponenten SNAP und NSF
eine wichtige Rolle spielen, indem sie die v- zu t-SNARE-Bindung
stabilisieren und die Fusion einleiten.
Die Fusion ist noch wenig verstanden, allerdings hat bei einigen
viralen Elementen Proteine gefunden, die in Abhängigkeit vom pH-Wert
eine hydrophobe Domäne frei legen und mit dieser dann an der
Lipidmembran binden. Man nimmt an, dass der Mechanismus bei Säugern
ähnlich ist.
Damit jedes Vesikel an das richtige Kompartiment transportiert wird,
benötigt es eine Kennzeichnung auf der Oberfläche und dort angekommen
muss es ein Signal geben, das dazu führt, dass das Vesikel mit der
Membran verschmilzt.
Man nimmt an, dass als Signal für die Erkennung des Zielkompartiment
sogenannte SNAREs dienen. Das Zielkompartiment enthält einen t-SNARE
(target), an den der v-SNARE des Vesikels spezifisch bindet.
Die Lysosomen enthalten ein Gemisch saurer Hydrolasen (Nukleasen,
Proteasen, Glykosidasen, Lipasen, Phospholipasen, Sulfatasen,
Phosphatasen, ...), die alle bei dem dort herrschenden pH von 5,0 ihre
optimale Wirkung entfalten. Durch diesen pH können die Enzyme bei
einer Beschädigung des Lysosoms im Cytoplasma bei einem
physiologischen pH keinen Schaden anrichten.
Die Lysosomen weisen eine sehr uneinheitliche Morphologie auf.
Sie weisen aber immer die charakteristischen sauren Hydrolasen auf und
dienen in den meisten Fällen der Hydrolyse von Markemolekülen, deren
Bausteine dann die Membran der Lysosomen passieren und im Cytoplasma
wieder zur Verfügung stehen.
Die Vakuolen der Pflanzenzellen sind ebenfalls mit den Lysosomen
verwandt, auch wenn sie als Nährstoffspeicher, Regulatoren des
Turgor-Drucks und des pH eine vollkommen andere Funktion als die
Lysosomen haben.
Die zum Abbau bestimmten Substanzen können die Lysosomen auf
unterschiedlichen Wegen erreichen:
Ein Weg ist die Aufnahme von Material aus der Umgebung durch
Endocytose. Dabei kommt es zu einer Membraneinstülpung, aus der sich
ein frühes Endosom abschnürt. Dieses entwickelt sich zu einem späten
Endosom (pH 6) und wird durch Kombination mit den sauren Hyrolasen aus dem
Golgiapparat zu einem Lysosom.
Durch Autophagie werden zum Abbau bestimmte Organellen, wie z.B. ein
Mitochondrium zunächst von einer aus dem ER stammenden Membran
umschlossen und dann durch Fusion mit einem Lysosom verdaut.
Man vermutet, dass eventuell eine bestimmte Sequenz - die
KFERQ-Sequenz - als Marker für die zum Abbaus bestimmten Proteine
dient.
Bei der Phagocytose wird eine Beute von der Plasmamembran umschlossen
und in die Zelle eingeschlossen. Das so entstandene Phagosom
fusioniert dann ebenfalls mit einem Lysosom und die Beute wird
verdaut.
Die sauren Hydrolasen werden durch ein spezielles Signal, das
Mannose-6-Phosphat (M6P) - Signal markiert und im trans-Golgi-Netzwerk
von einem M6P-Rezeptor erkannt. Bei dem dort herrschenden
physiologisch pH bindet der Rezeptor fest an das Oligosaccharid. Dann
folgt eine Abschnürung eines Vesikels und der Transport in ein spates
Endosom. Dort herrscht ein pH, der den Rezeptor von dem Oligosaccarid
ablöst. Der Rezeptor wird zurück zum trans-Golgi-Netzwerk
transportiert.
In einigen Fällen werden die sauren Hydrolasen auch zur Plasmamembran
transportiert. Dieser Fehler wird teilweise dadurch ausgeglichen, dass
auch die Rezeptoren teilweise zur Plasmamembran transportiert werden
und dort dann die Hydorlasen ,,wieder einfangen``.
Das M6P-Signal wird im Golgiapparat an alle Proteine angehängt, die
eine spezifische Erkennungssequenz tragen.
Unter Endozytose versteht man den Vorgang, bei dem die zelle durch ein
Einstülpen der Membran Stoffe aus dem Extrazellulärraum
aufnimmt. Handelt es sich dabei um feste Stoffe, spricht man von
Phagozytose, bei Flüssigkeiten von Pinozytose. Pinozytose findet man
bei praktisch allen Zellen, während die Phagozytose auf einige
spezialisierte Zellen beschränkt ist.
Bei den Säugern wird die Phagozytose vor allen von zwei Zellen
ausgeführt, die beide dem Immunsystem angehören: Den Makrophagen und
den neutrophilen Leukozyten.
Die Phagozytose ist ein aktiver Prozess, der erst durch ein Signal
ausgelöst werden muss. Die Makrophagen beispielsweise erkennen mittels
bestimmter Rezeptoren die Fc-Region eines Antikörpers oder das
Komplementsystem und binden an die so gekennzeichneten Zellen.
Dann bildesn sie Pseudopodien aus und umschliessen den Fremdkörper,
der daraufhin in ein Lysosom verwandelt wird. Der Inhalt des Lysosoms
wird verdaut und die unverdaulichen Reste bilden ein Restkörperchen
(residual body).
Die Pinozytose ist ein bei allen Zellen kontinuierlich ablaufender
Prozess, durch den die Zelle Flüssigkeit aus der Umgebung aufnimmt.
Die Pinozytose beginnt an einem clathrin-coates pit, einer Einstülpung
der Membran, deren dem Cytosol zugewandte Seite mit Clathrin bedeckt
ist. Innerhalb einer Minute schnüren sich an diesen Stellen die
clathrin coated vesicles ab, welche nach einer noch kürzeren Zeit mit
Endosomen verschmelzen.
In den meisten Fällen ist die Pinozytose eine rezeptorvermittelte
Endozytose, bei der eine Substanz an Rezeptoren gebunden wird, diese
sich in den coated pit - Regionen ansammeln und dann zusammen mit der
Substanz in die Zelle aufgenommen werden. So können spezifisch Stoffe
wie z.B. Cholesterin in die Zelle aufgenommen werden. Diese werden
dann meist von den frühen über die späten Endosomen zu den Lysosomen
transportiert, lysiert und weiter verwertet.
Einige Stoffe bleiben allerdings auch an ihren Rezeptor gebunden und
werden mit ihm zusammen entweder zurück zur gleichen Stelle an der
Plasmamembran, zum Abbau in ein Lysosom oder an eine andere Stelle der
Plasmamembran (Tranzytose) tranportiert.
Diese unterschiedlichen Möglichkeiten haben verschiedene Auwirkungen
auf die Zelle. Werden die Rezeptoren in das Lysosom transportiert und
abgebaut, so verringert sich die Rezeptordichte, werden sie hingegen
recyclet, so brauchen keine neuen Rezeptoren synthetisiert werden.
Die Transzytose wird vor allem dazu verwendet, um Substanzen durch ein
Epithel hindurch zu transportieren. Dies findet z.B. bei der Bildung
des Immunsystems bei der Ratte seine Anwendung. Durch Transzytoser
gibt die Mutter Antikörper in die Milch ab; diese werden im Darm des
Jungtieres durch den gleichen Mechanismus aufgenommen und in dessen
Blut transportiert.
Bei den Epithelzellen befinden sich zwei getrennte frühe
Endosomenkopartimente, eines der basolateralen und eines der apikalen
Seite. Diese beiden verbinden sich dann zu einem gemeinsamen Lysosom.
Da trotz kontinuierlicher Pinozytose die Membranoberfläche konstant
bleibt, muss ein Rücktransport der Vesikel zur Membran
stattfinden. Dieser Prozess wird Exozytose genannt.
Neben diesem konstitutiven Ausscheidungsweg, den man bei allen Zellen
findet, gibt es einen weiteren gesteuerten Ausscheidungsweg über
sekretorische Vesikel. Wegen ihrer im EM undurchsichtigen Zentren
bezeichnet man die sekretorischen Vesikel oftmals auch als
sekretorische Granula.
Sekretorische Vesikel werden auf ein bestimmtes Signal hin
freigesetzt. Dazu benötigen sie eine Kennzeichnung, die sie von den
anderen, konstitutiv ausgeschütteten Vesikeln unterscheidet.
Die in den sekretorischen Vesikeln verpackten Proteine bilden auf ein
unbekanntes Signal hin innerhalb des Golgiapparates Aggregate. Diese
Aggregation ist sehr wahrscheinlich das Signal, auf das hin die
Proteine vom Golginetzwerk abgeschnürt werden und zu sektretorischen
Vesikeln werden.
Viele der Proteine sind Prä-Pro-Proteine, die am Aminoende ein
Prostück besitzen, welche in Golginetzwerk oder in den Vesikeln
proteolytisch entfernt wird, so dass das aktive Protein entsteht. Als
das Prä-Stück wird ein bereits im ER entferntes Signalpeptid
bezeichnet. Die Aktivierung der Proteine in den sekretorischen
Vesikeln oder erst nach der Freisetzung bewirkt, dass die Zellen vor
etwaigen schädlichen Einflüssen dieser Proteine geschützt
ist. Ausserdem sind viele Proteine zu kurz, um in das ER transportiert
zu werden. Auch in diesem Fall ist es sinnvoller ein grosses Peptid zu
importieren und dieses dann zu spalten.
Die Sekretorischen Vesikel warten, nachdem sie beladen wurden in der
Nähe der Plasmamembran auf ein Signal auf das hin sie dann freigesetzt
werden. Bei dem Transport der Vesikel zur Zielmembran spielt sehr
wahrscheinlich die Ausrichtung der Mikrotubuli eine entscheidende
Rolle.
Das eigentliche Signal für die Aussschüttung der Vesikel ist häufig
ein Anstieg der Calciumionenkonzentration.
Die Speicherung der synaptischen Vesikel verläuft ein wenig anders als
die der restlichen sekretorischen Vesikel, da diese wesentlich
schneller wieder aufgefüllt werden müssen, als dies sonst der Fall
ist. Man nimmt an, dass die Membranen der Vesikel nachdem diese
ausgeschüttet wurden wieder aufgenommen werden, zu den Endosomen
transportiert werden, wo sich wieder synaptische Vesikel abschnüren
und über Membrantransporter mit dem richtigen Neurotransmitter beladen
werden.
Ein noch nicht gelöstes Problem ist, wie die Vesikel bei polaren
Zellen, wie z.B. dem Epithel der richtigen Seite zugeordnet werden.
|





