Unterabschnitte
Immunsystem
Die Antwort des Immunsystems wird von den Leukozyten vermittelt.
Diese lassen sich in die im Thymus entstehenden T-Zellen und die im
Knochenmark entstehenden B-Zellen einteilen.
Die letzteren produzieren Antikörper, während die T-Zellen für die
zellvermittelte Immunantwort verantwortlich sind. Die Klasse der
T-Helfer-Zellen verstärkt die Antikörperantwort anderer Zellen.
Die Lymphozyten entstehen bei den Säugern in Thymus und Knochenmark
und bei den Vögeln aus Thymus und Bursa Fabricii. Dort entwickeln sich
die Zellen aus pluripotenten hämopoietischen Stammzellen; man
bezeichnet die Organe deshalb auch als primäre lymphoide Organe. Wenn
die Zellen nicht sterben, werden sie über die Blutbahn in die
sekundären lymphoiden Gewebe transportiert, die Lymphknoten und die
Milz.
Im inaktivierten Zustand sind die beiden Lymphocyten nur schwer zu
unterscheiden. Nach dem Kontakt mit einem Antigen verändern sich die
Zellen. Die B-Zellen werden zu Antikörper-sezernierenden Plasmazellen,
während die T-Zellen keine Vesikel bilden, dafür aber Botenstoffe wie
Interleukine, Cytokine und Lymphokine ausschütten.
Im Labor kann man die Zellen anhand ihrer Oberflächenproteine mit
Antikörpern identifizieren.
Nach der Theorie der klonalen Selektion wird ein zufälliges Sortiment
von Zellen zunächst hergestellt. Wenn dann ein Antigen erscheint,
reagiert es mit der Zelle, die den richtigen Rezeptor besitzt und
diese fängt dann an, sich zu vermehren. Dies konnte man durch
selektives Zerstören der Zellen für ein bestimmtes Antigen oder mit
einer Affinitätssäule, die Zellen für ein bestimmtes Antigen aus der
Population entfernt durch die dann ausbleibende Immunantwort
nachweisen.
Bei der Reaktion auf ein Antigen kann man eine polyklonale Antwort,
bei der hunderte von Antikörpern produziert werden, von einer
oligoklonalen, bei der nur einige Zellen reagieren und eine
monoklonalen, bei der nur eine einzige Zelle reagiert, unterscheiden.
Die Antigene werden an den sekundären lymphoiden Organen Milz
(Antigene im Blut), Lymphbahnen (Antigene durch die Haut) und
lymphoides Gewebe des Magen-Darmtraktes gesammelt und den Lymphozyten
von sogenannten Antigen-präsentierenden Zellen präsentiert.
Die Lymphocyten wandern von der Blutbahn durch das Endothel in die
Lymphgefässe und von dort wieder in die Blutbahn, so dass sie mit den
Lymphknoten in Kontakt kommen.
Diese Wanderungen werden von den sogenannten Homing-Rezeptorem auf den
Lymphocyten und ihren Gegenrezeptoren auf den Endothelzellen
gelenkt. Das schwache Anhefen an das Blutgefäss wird von Selektinen
vermittelt, das starke Anhaften und Eindringen in die Endothelzellen
ist von Integrinen abhängig.
Kommt der Körper das erste mal mit einem Antigen in Kontakt, kommt es
zu einer primären Immunantwort, die durch einen relativ schnellen Anstieg
und dann ein langsames Abklingen gekennzeichnet ist. Wenn man später
das Antigen nochmals präsentiert, dann fällt die Antwort stärker aus,
der Antieg ist schneller und die Reaktion klingt weniger schnell ab.
Dieses Phänomen wird von der Theorie der klonalen Selektion
erklärt. Es gibt im Körper drei Stufen der Lymphozyten-Aktivierung:
Sobald sogenannte immunkompetente Zellen das ersten Mal auf ein
Antigen treffen, teilen sie sich und werden zu Effektorzellen,
d.h. sie führen die für ihre Zellart typische Immunantwort aus. Andere
immunkompetente Zellen teilen sich ebenfalls werden aber nicht zu
Effektor-, sondern zu Gedächtniszellen. Diese starten zwar keine
Immunantwort, sind dafür aber im Gegensatz zu den Effektorzellen sehr
langlebig und können zu einem späteren Zeitpunkt sehr schnell eine
grosse Menge Effektorzellen produzieren, ausserdem reagieren sie
schneller oder mit höherer Affinität auf das Antigen.
Das Immunsystem lernt während der Embryogenese, nicht gegen eigene
Zellen vorzugehen. Die kann man nachweisen, indem man in diesem
Stadium fremde Zellen injiziert; diese werden in die erworbene
immunologische Toleranz einbezogen.
Wenn dieser Prozess gestört ist, kommt es zu Autoimmun-Krankheiten wie
Myathenia gravis, bei der AK gegen die ACh-Rezeptoren des Muskels
gebildet werden.
Antikörper
Die Antikörper werden auch als Immunglobuline (Ig) bezeichnet.
Die einzigen Zellen, die Antikörper produzieren können sind die
B-Zellen. Die ersten von einer B-Zelle produzierten AK werden in die
Plasmamembran der Zelle eingesetzt und dienen als Rezeptoren. Diese
sind über eine TMD mit dem Zellinneren verbunden und signalisieren die
Bindung eines Antigens. Bei Bindung eines Antigens wird die Zelle dann
zur Plasmazelle und erzeugt eine Immunantwort.
Ein einfacher Test um Zellen, die AK produzieren zu zählen ist der
hämolytische Plaque-Test. Dabei werden gegen ein Protein immunisierte
Lymphozyten mit dem an die Oberfläche von Schaferythrocyten gebundenem
Protein in einem Agar gemischt und fixiert. Dort wo die AK das Protein
erkennen können die Erythrocyten durch Komplement zerstört werden. So
entstehen Plaques, deren Anzahl der Anzahl an AK produzierenden Zellen
entspricht.
Antikörper sind bivalent, d.h. wie ein Y aufgebaut und können so
grosse Netzwerke bilden.
Die AK bestehen aus zwei schweren H- und zwei leichten L-Ketten.
Durch Papain kann man die AK in zwei Fab (fragment antigen binding) -
Fragmente mit einer Antigen-erkennenden Region und ein Fc (fragment
crystallizing) - Fragment spalten.
Pepsin erzeugt zwei miteinander verbundene Fab-Fragmente und
zerschneidet den Rest in kleine Bruchstücke. Durch den fehlenden Fuss
können aber auch diese Fragmente keine Immunreaktion mehr steuern.
Bei den Wirbeltieren findet man fünf Klassen von AK: IgA, IgD, IgE,
IgG und IgM, deren H-Ketten untschiedlich aufgebaut sind.
Die Klasse der IgM-AK wird von der Zelle in der Entwicklung immer
zuerst produziert. Die IgM-H-Ketten verbinden sich zunächst mir
sogenannten Stellvertreter-L-Ketten und werden in die Plasmamembran
eingelagert. Sobald die Zelle beginnt die L-Ketten zu synthetisieren,
binden diese an die H-Ketten und die Zelle ist von jetzt an
immunkompetent.
In späteren Entwicklungsstadien bildet die Zelle an Stelle der
IgM-Rezeptoren häufig auch IgD-AK, die jedoch selten sezerniert
werden.
In den frühen Stadien einer Immunantwort werden vor allem IgM-Zellen
ins Blut abgegeben. Diese Form ist aus fünf Y-förmigen AK aufgebaut un
besitzt eine zusätzliche J-Kette. Die Fc-Region führt zu einer ersten
Komplementaktivierung.
Während der sekundären Immunantwort werden vor allem IgG-AK ins Blut
abgegeben. Die IgG-AK aktivieren nicht nur das Komplement, sondern
vermitteln auch die Bindung von Makrophagen und Neurtophilen.
Diese AK-Klasse wird dem Neugeborenen über die Plazenta übertragen und
auch mit der Muttermilch abgegeben.
Die Klasse der IgA bindet extrazelluläre an Epithelzellen, wird dann
von diesen aufgenommen und über sekretorische Granula in den
Körpersekreten (Speichel, Tränen, Milch...) freigesetzt.
Die Fc-Region der IgE-Zellen hingegen bindet an die Mastzellen und die
Basophilen. Sie dienen dort als Rezeptor. Wenn ein Antigen bindet,
dann reagiert die Zelle mit einer Ausschüttung von Histaminen. Die
Mastzellen sezernieren ausserdem einen Faktor, der Eosinophile
anlockt, damit diese dann den Parasiten töten.
Neben den zwei Klassen von schweren gibt es auch zwei Klassen von
L-Ketten: Die 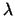 - und die - und die 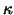 -Kette. Dies können an jede
H-Kette binden; allerdings bindet immer nur ein Typ an einen
Antikörper, da sonst zwei unterschiedliche Bindungstellen entstünden
und eine Quervernetzung nicht mehr möglich wäre. -Kette. Dies können an jede
H-Kette binden; allerdings bindet immer nur ein Typ an einen
Antikörper, da sonst zwei unterschiedliche Bindungstellen entstünden
und eine Quervernetzung nicht mehr möglich wäre.
Durch die Kombination von L- und H-Kette entstehen zwei Epitope, die
spezifisch an ein Antigen binden. Ähnlich der Gleichgewichtskonstante
einer chemischen Reaktion gibt es auch bei AK eine
Affinitätskonstante 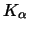 , die um so höher ist, je fester der AK an das
Antigen bindet. Des weiteren steigt die gesamte Bindungsstärke -
Avidität genannt - stark an, wenn das Antigen mehrere Bindungsstellen
aufweist und die AK so Komplexe formen können. , die um so höher ist, je fester der AK an das
Antigen bindet. Des weiteren steigt die gesamte Bindungsstärke -
Avidität genannt - stark an, wenn das Antigen mehrere Bindungsstellen
aufweist und die AK so Komplexe formen können.
Die Aufklärung der dreidimensionalen Stuktur hat grosse Fortschritte
gemacht, als man Krebszellen im Knochenmark entdeckte, die einen
monoklonalen Antikörper herstellen. Dieser - als Myelom-Protein
bezeichnet - konnte dann zur Strukturaufklärung verwendet werden.
Bei der genetischen Analyse fiel auf, dass die leichte und die schwere
Kette an ihrem Aminoterminus eine hochvariable Region tragen; während
der carboxyterminale Rest relativ konstant ist.
Die Variabilität der variablen Regionen ist im wesentlichen auf drei
relativ kleine hypervariable Regionen begrenzt; der Rest, die
framework regions (FR) sind relativ konstant. Man teilt deshalb die
leichte Kette in eine Konstante und eine variable Region ein; die
schweren Ketten besitzen drei (und bei IgM und IgE sogar vier)
konstante und eine variable Region.
Durch Röntgenstrukturanalyse konnte die 3d-Struktur der Antikörper
aufgeklärt werden. Dabei fand man heraus, dass die AK mit jeder
hypervariablen Region eine Oberflächenschleife binden.
Das Komplement besteht aus ca. 20 löslichen Proteinkomponenten, die
frei im Blut zirkulieren. Bei einer Aktivierung durch einen AK oder
einen Mikroorganismus bilden sie einen Komplex, der die Membran eines
Eindringlings zerstört.
Das Komplement kann entweder durch AK oder durch Polysaccharide auf
der Oberfläche von Mikroorgansimen ausgelöst werden. In beiden Fällen
wird das Komplement C3 aktiviert, das seinerseits die Bildung des
Komplexes einleitet und zur Erneuerung weisser Blutzellen führt. Alle
weiteren Komplemente - wie auch das C3 - sind Proenzyme, die nach
ihrer Aktivierung in Form einer Serin-Protease die folgenden Proenzyme
aktivieren.
Diese Komplexe bilden eine wässrige transmembrane Pore und
beeinträchtigen die Lipid-Doppelschicht. Die Zelle wird dann durch den
osmotischen Gradienten getötet. Nach ihrer Aktivität zerfallen die
Komplement-Proteine entweder von selbst oder sie werden durch
Proteasen inaktiviert.
Durch Restriktionsanalyse fand man bei reifen B-Zellen die Bereiche
der C- und der V-Region nahe beieinander, während sie in dem Embryo
noch weit auseinander liegen.
Die Gene der Antikörper werden durch eine Umlagerung der DNA gebildet
und können - durch veränderte Enhancer-Strukturen - auch erst nach
dieser Umordnung translatiert werden.
Die Konstante C-Region der leichten Kette wird immer von einem
C-Gen-Segment kodiert. Die
variable Region setzt sich hingegen immer aus einem kurzen
J-Gen-Segment und einem längeren V-Gen-Segment zusammen.
Bei der schweren Kette wird das Protein von drei Regionen, deinem V-
einem J- und einem D-Gen-Segment kodiert.
Der genaue Mechanismus, wie die Kombination funktioniert sind noch
nicht bekannt. Es schein aber so, dass zwei Gene rag-1 und rag-2 für
die Proteine der V(D)J-Rekombination kodieren.
Dadurch ergibt sich die kombinatorische Vielfalt der AK.
Bei der Verknüpfung der Immunglobulin-Gen-Segmente wird an den Rändern
ungenau verfahren, so dass es zu einer Verknüpfungsvielfalt kommt, die
die Diversität nochmals steigert.
Nach der Aktivierung des B-Lymphozyten wird die Immunantwort
spezifischer, da gehäufte Punktmutationen die Affinität nochmals
erhöhen. Dieser Prozess wird Affinitätsreifung genannt. Auf Grund der
hohe Mutationsrate bezeichnet man diesen Prozess auch als somatische
Hypermutation.
Bei der Bildung der Antikörper muss eines der beiden Chromosomen
inaktiviert werden (Allel-Ausschliessung) und dann muss entweder der
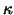 - oder der - oder der 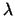 -Leichtkettenpool inaktiviert werden.
Die molekularen Grundlagen dieses Prozesses sind noch nicht geklärt. -Leichtkettenpool inaktiviert werden.
Die molekularen Grundlagen dieses Prozesses sind noch nicht geklärt.
Die Unterscheidung zwischen einem membrangebundenen AK und einem
sezernierten fällt dadurch, dass entweder ein hydrophobes
(membrangebunden) oder ein hydrophiles (sezerniert) C-terminales Ende
gebildet wird.
Eine weitere Variation ist der schon oben angesprochene
Klassenwechsel, bei dem eine Zell z.B. an Stelle von IgM AK vom Typ
IgD synthetisiert.
Durch diesen Klassenwechsel ist es möglich, dass die Bindungsstelle
für eine einmal erkannte Sustanz auf alle Typen von Ig übertragen
werden kann.
Die genauen Mechanismen sind noch nicht bekannt; man vermutet eine
Veränderung im RNA-Processing oder bei einer reifen Zelle eine
irreversible Switch-Rekombination auf DNA-Ebene.
T-Zell-Rezeptoren
Die T-Zellen erkennen ein fremdes Antigen nur dann, wenn es sich auf
der Oberfläche einer Zelle befindet. Sie können ihre Rezeptoren nicht
sezernieren; ihre Antwort wird deshalb auch zell-vermittelte Antwort
genannt.
Man kann die Zellen in die cytotoxischen Zellen, die eine Zielzelle
direkt töten und die Helferzellen, die die Immunabwehr anderer Zellen
stimulieren, unterscheiden.
Beide Typen von T-Zellen besitzen Rezeptoren, die aus zwei
Polypeptidketten - durch eine Disulfidbrücke verbunden - bestehen.
Diese Ketten ( und und 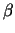 ) haben eine variable aminoterminale
und eine konstante C-terminale Region.
Auch die T-Zellen verwenden die V(D)J-Rekombination zum Herstellen der
genetischen Variabilität. Somatische Hypermutation scheint hingegen
nicht statt zu finden. ) haben eine variable aminoterminale
und eine konstante C-terminale Region.
Auch die T-Zellen verwenden die V(D)J-Rekombination zum Herstellen der
genetischen Variabilität. Somatische Hypermutation scheint hingegen
nicht statt zu finden.
Die Erkennung beruht auf dem Erkennen von spezifischen
Antigen-Abbauprodukten, die von sogenannten MHC-Proteinen auf der
Oberfläche der Zielzelle präsentiert werden. Die MHC-Moleküle (von
major histocompatibility complex). Die Gene für dieses Glykoprotein
zeigen dne höchsten bei Vertebraten bekannten Polymorphismus. Man
findet innerhalb einer Art bis zu hundert Allele.
Man kann die MHC-Moleküle in zwei Klassen unterteilen.
Das Klasse-I-MHC-Gen besteht aus einer  -Kette, die
extrazellulär in drei Domänen gefaltet ist und an einer dieser Domänen
nicht-kovalent ein -Kette, die
extrazellulär in drei Domänen gefaltet ist und an einer dieser Domänen
nicht-kovalent ein 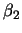 -Mikroglobulin gebunden hat. -Mikroglobulin gebunden hat.
Die Klasse-II-MHC-Moleküle sind Heterodimere und weisen wie auch das
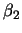 -Mikroglobulin und die -Mikroglobulin und die 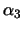 -Domände der Klasse I eine
Ähnlichkeit zu den Immunglobulinen auf. -Domände der Klasse I eine
Ähnlichkeit zu den Immunglobulinen auf.
Die Aufgabe dieser Moleküle ist es, Peptidfragmente eines fremden
Proteins den T-Zellen zu präsentieren.
Das Klasse-I-MHC-Protein hat eine Antigen-Bindungsselle in Form einer
von zwei  -Helices gebildeten Furche. Diese Furche kann ein
Peptid von 10 Aminosäuren Länge aufnehmen. Diese wird fest gebunden
und zwar so, dass die Seitenketten der Aminosäuren nach aussen
weisen. Unterschiedliche MHC-Proteine präsentieren unterschiedliche
Polypeptide. -Helices gebildeten Furche. Diese Furche kann ein
Peptid von 10 Aminosäuren Länge aufnehmen. Diese wird fest gebunden
und zwar so, dass die Seitenketten der Aminosäuren nach aussen
weisen. Unterschiedliche MHC-Proteine präsentieren unterschiedliche
Polypeptide.
Die Klasse-II-MHC-Proteine haben eine vergleichbare Stuktur, binden
aber an Peptide, die etwas länger sind (15 bis 23 AS).
Die Proteine der Klasse I findet man auf praktisch allen Zellen, die
einen Kern besitzen. Wenn eine Zelle selbst fremde Antigene produziert
bindet eine T-Zelle und tötet die Zelle.
Die Klasse II-Proteine findet man hingegen vor allem bei
B-Lymphocyten, wo sie den T-Helfer-Zellen Antigene präsentieren. Diese
helfen der B-Zelle dann bei der AK-Produktion und aktivieren
Makrophagen.
In beiden Fällen findet man Co-Rezeptoren auf der Oberfläche der
T-Zellen, die die selektive Bindung an ein MHC-Protein verstärken. Die
am besten untersuchten Co-Rezeptoren sind die CD4- und CD8-Proteine.
Diese Proteine sind mit einer TMD in der Membran verankert und binden
über eine Ig-ähnliche extrazelluläre Domäne an die invarianten Teile
des MHC-Proteins. CD4 wird auf Helferzellen und CD8 auf den
cytotoxischen T-Zellen exprimiert.
Die Co-Rezeptoren dienen der Verstärkung der Zelladhäsion und sind
ausserdem die Angriffststelle des AIDS-Virus.
Die cytotoxischen T-Zellen erkennen die Partikel eines Virus nur dann,
wenn er an die Körpereigenen MHC-Rezeptoren gebunden ist.
Man geht davon aus, dass bestimmte Proteasomen für die Herstellung von
an MHC-Proteine bindende Proteine besonders geeignet sind. Die
Proteinfragmente werden von einem spezialisierten Protein in das
Innere des ER gepumpt, wo diese dann an die MHC-Proteine binden. Diese
werden dann zur Oberfläche transportiert und können von T-Zellen
erkannt werden.
Nach ihrer Aktivierung sezerniert die cytotoxische T-Zelle Botenstoffe
wir Interferon, das die antiviralen Zellfunktionen verstärkt.
Der genaue Mechanismus der Zelltötung ist nicht bekannt. Eine
Strategie scheint wohl in der Bildung eines Poren-bildenden Moleküls,
dem Perforin zu liegen. Dessen Struktur und Funktion scheint dem
Komplement-Komplex C9 zu ähneln. Ausserdem scheinen auch
Serin-Proteasen eine wichtige Rolle bei der Tötung der Zelle zu
spielen.
Die den T-Helferzellen präsentierten Peptide stammen von
Mikroorganismen im extrazellulären Raum oder deren Syntheseprodukten,
welche zuvor von Antigen-präsentierenden Zellen aufgenommen und
lysiert wurden.
Im reifen Endosom werden diese Peptide an die Klasse-II-MHC-Proteine
gebunden und der T-Helferzelle präsentiert. Diese werden im ER
gebildet. Dort bindet zunächst eine invariante Kette an das
Protein. Diese verhindert, dass andere Peptide an die Kette binden und
dirigiert die Proteine vom trans-Golgo zum endosomalen Kompartiment.
Die Aktivierung einer T-Zelle erfolgt durch eine
Antigen-präsentierende Zelle, an der die T-Zelle an ein MHC-Molekül
bindet.
Die Aktivierung ist noch nicht völlig verstanden, allerdings ist der
Rezeptor wohl mit anderen Polypeptiden verbunden und bildet den
sogenannten CD3-Komplex. Man vermutet, dass der Rezeptor eine Anzahl
von Tyrosinkinasen aktiviert, deren Phosphorylierung der Phospholipase
C dann einen IP3-Weg auslöst.
Bei der T-Helferzelle müssen zur Aktivierung zwei Signale vohanden
sein: Ein fremdes Peptid an ein Klasse-II-MHC-Molekül gebunden und ein
Botenstoff, wie z.B. Interleukin-1.
Wenn sie aktiviert wird, beginnt sie selbst eine Reihe von
Interleukinen zu sezernieren, ausserdem verstärken akzessorische
Proteine die Bindung an die Zielzelle.
Als weiteres Resultat der Bindung beginnt die Zelle eine
Proliferation. Sie sekretiert Interleukin-2, einen Wachstumsfaktor und
zugleich werden Rezeptoren für diesen Faktor an der Oberfläche
exprimiert. Die Bindung des Faktors an den Rezeptor führt dann direkt
zur Proliferation. So kann eine Zelle auch nach der Bindung an den
Antikörper mit ihrer Antwort fortfahren und sie kann andere Zellen zur
Proliferation stimulieren - vorausgesetzt, diese haben ebenfalls ein
Antigen gebunden.
Diesen Mechanismus kann man ausnutzen, indem man T-Zellen in Kulur mit
Interleukin-2 und ihrem Antigen versorgt und so eine unbegrenzr
proliferationsfähige Linie von T-Zell-Klonen zu erhalten.
Es gibt zwar einige grosse Polysaccharide, die auch ohne die
T-Helferzellen eine Immunantwort auslösen; im Allgemeinen sind jedoch
beide Zelltypen vorhanden.
Die T-Helferzellen werden vor allen für die Bildung der
Gedächtniszellen und den Wechsel der AK-Klasse benötigt. Sie wirken
über zwei Wege auf die B-Zellen ein: Zum einen präsentieren die der
Zelle ein Antigen und bilden gleichzeitig an den CD40-Rezeptor der
B-Zelle; zum anderen sezernieren die Interleukine, die auf die B-Zelle
wirken und dort auch zu einem Wechsel der AK-Klasse führen können.
Man kann die T-Helferzellen in TH1-Zellen, die IL-2 und
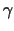 -Interferon sezerniern und mit den cytotoxischen T-Zellen und
Makrophagen kooperieren und die TH2-Zellen, die durck Sekretion von
IL-4 und IL-5 mit den B-Zellen zusammenarbeiten, unterscheiden. -Interferon sezerniern und mit den cytotoxischen T-Zellen und
Makrophagen kooperieren und die TH2-Zellen, die durck Sekretion von
IL-4 und IL-5 mit den B-Zellen zusammenarbeiten, unterscheiden.
Die TH1-Zellen verstärken die Aktivität der Makrophagen und der
cytotoxischen T-Zellen. Des weiteren aktiviert 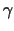 -Interferon
auch andere Zellen dazu, den T-Helferzellen Antigene zu präsentieren. -Interferon
auch andere Zellen dazu, den T-Helferzellen Antigene zu präsentieren.
T-Zellen erkennen Antigene in Verbindung mit den eigenen
MHC-Proteinen, nicht jedoch mit fremden. Dies wird MHC-Restriktion
genannt. Diese Spezialisierung wird durch eine Selektion im Thymus
gewährleistet.
Es überleben in einem ersten Schritt nur die Zellen, die das
MHC-Protein des eigenen Körpers erkennen. Diesem positiven folgt ein
negativer Ausleseprozess, der die Zellen davon abhalten soll, die
unbefallenen Körperzellen anzugreifen.
Dies wird dadurch erreicht, dass die Zellen, die stark an das
MHC-Protein binden eliminiert werden; die Zellen die gar nicht daran
binden werden ebenfalls getötet und nur die mit einer schwachen
Bindung an das Protein überleben.
Die negative Auslese findet sehr wahrscheinlich an Makrophagen statt,
während die positive im Epithel des Thymus stattfindet.
Wenn ein fremdes Antigen an ein MHC-Protein bindet und dieses nach der
Bindung einem anderen körpereigenen MHC-Protein gleicht, findet keine
Immunreaktion statt.
Aus diesem Grund sind die MHC-Gene so hoch variabel: So bieten sie
einen optimalen Schutz gegen fremde Antigene; allerdings darf ihre
Zahl nicht erhöht werden, da sonst die Zahl der T-Zellen, die deshalb
inaktiviert werden muss wiederum steigt und der Vorteil verloren
ginge.
|





