Unterabschnitte
Ionenkanäle
Da der Durchtritt von polaren Ionen durch eine unpolare Lipidmembran
energetisch sehr unguenstig ist, muss der Durchtritt von Ionen durch
die Membran von Kanalproteinen geregelt werden.
Ionenkanäle sind Transmembranroteine, die durch eine enge Stelle im
Inneren als ein Selektivistätsfilter wirken. An dieser Stelle kann das
Ion dann durch die Bindung an eine Aminosäure einen Teil seiner
Hydrathülle durch eine AS-Bindung ersetzen. Da dies energetisch
günstig ist, wird der Durchlass begünstigt - allerdings nur dann, wenn
das für die Bindung vorgesehene Ion bindet. D.h. durch Grösse der
Pore und Spezifität der Bindung wird eine Filterfunktion geschafffen.
Charakteristisch für einen Ionenkanal ist die Leitfähigkeit, die
Siemens (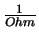 ) angegeben wird. Wenn die Ionen den Kanal in
einer Richtung leichter passieren, dann spricht man von einem
gleichrichtenden Kanal. ) angegeben wird. Wenn die Ionen den Kanal in
einer Richtung leichter passieren, dann spricht man von einem
gleichrichtenden Kanal.
Praktisch alle Kanäle wechseln zwischen mehreren Konformationen in
Abhängigkeit von:
- Spannungabhängig: Dadurch, dass eine ladungstragende Region in
den Kanal rein oder raus bewegt wird, verändert dieser seine
Konformation und öffnet oder schliesst sich.
- Lingandenabhängig: Durch die Bindung des Liganden entsteht eine
Energie, die zur Öffnung des Kanals führt.
- Mechanisch: Durch die kinetische Energie der Dehnung, die auf
das Cytoskelett übertragen wird, öffnet sich der Kanal.
- Phosphorylierung: Durch Phosphorylierung einr Aminosäure wird
die Konformation des Kanals direkt beeinflusst.
Refraktärzustände können ebenfalls auf unterschiedliche Art und Weise
erzeugt werden: Nämlich spannungsabhängig, calciumabhängig oder durch
eine Dephosphorylierung.
Für jeden Ionenkanal gibt es unterschiedliche Agonisten, die an ihn
binden können:
- Endogener Agonist: führt zur natürlichen Reaktion.
- Exogener Agonist: führt zu keiner Reaktion.
- Reversibler Agonist: füht zu einer reversiblen Bindung.
- Irreversibler Agonist: führt zu einer irreversiblen Bindung.
Das Bindungsverhalten der Kanäle kann in verschiedenen Zelltypen und
in verschiedenen Entwicklungsstadien durch differentielle
Genexpression oder alternatives Splicen unterschiedlich sein.
Hememnde Wirkung
Soll eine hemmendende Wirkung erzielt werden, so dann dies entweder
durch das Öffnen von Kaliumkanälen oder durch Chloridkanäle
passieren. Letztere stabilisieren das Membranpotential auf einem
aktuellen Level: Es ist einer grössere Depolarisation nötig, um eine
Erregung auszulösen.
Untersuchungen an Ionenkanälen
Eine der am häufigsten verwendeten Techniken ist die von Neher und
Sakmann entwickelte Patch-Clamp-Technik, bei der mit einer mit
Elektrolyt gefüllten Glaspipette, in der sich eine Elektrode befindet,
ein Stück der Membran angesaugt wird. Durch Ableitung unter
Voltage-Clamp-Bedingungen kann man auf diese Weise den Strom über den
Kanal bestimmen.
Eine weitere Technik ist die Black-Film-Technik.
Bei dieser Untersuchungsmethode werden die Zellen homogenisiert und so
behandelt, dass sich Membranvesikel bilden. Diese kann man dann mit
einer künstlichen Membran zur Fusion bringen.
Vorteil dieser Technik ist, dass man das Milieu auf beiden Seiten der
Membran feri verändern kann.
Mittels Biochemischer und moelkulargenetischer Informationenen kann
man zunächst nach konstervatien und hochvariablen Bereichen
suchen. Die letzteren sind sehr wahrscheinlich für die
Bindungspezifität verantwortlich.
Mittels spezifischer Antikörper kann man zeigen, ob diese intra- oder
extracellulär binden.
Durch das Erstellen chimärer Mutanten aus zwei Kanälen oder durch
Punktmutationen und das Anschliessende Einbringen und Testen der so
erstellen Kanalproteine in Xenopus-Ooozyten (die selber keine Kanäle
aufweisen) kann man den Einfluss einzelner Aminosäuren auf die
Selektivität, die Leitfähigkeit oder andere Faktoren untersuchen.
Bei genetischen Analysen hat man herausgefunden, dass man die
Rezeptoren un zwei Genfamilien, in die der spannungsgesteuerten und
die der ligandengesteuerten Ionenkanäle einteilen kann.
Bei fast allen ligandengesteuerten Kanälen erfolgt die Öffnung
innerhalb von 1 ms bei einer Konzentration des Liganden von grösser
oder gleich 100 mol/l.
Man findet allerings sowohl bei metabotorpen, als auch bei ionotropen
Kanälen und bei Gap junctions einen gleichen Bauplan von
Transmembrandomänen, die um eine Achse herum angeordnet sind. Die
strukturellen Einheiten der Kanäle sind einander ähnlich. Bei allen
Kanälen koreliert die ionenselektivität mit dem Durchmesser und der
Anzahl der Untereinheiten. Ausserdem finden sich ähnliche
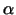 -Helices und -Helices und 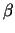 -Faltblätter im Aufbau und auch die
Funktionsweise des Öffnens und Schliessens durch Neigung oer Rotation
ist konserviert. Dies alles deutet auf einen gemeinsmen Vorfahren
aller Kanäle hin. -Faltblätter im Aufbau und auch die
Funktionsweise des Öffnens und Schliessens durch Neigung oer Rotation
ist konserviert. Dies alles deutet auf einen gemeinsmen Vorfahren
aller Kanäle hin.
Der Na-Kanal
Der Natriumkanal gerhört zusammen mit dem Kaium- und dem Calcium-Kanal
zu einer Familie von Kanälen, die sehr wahrscheinlich alle auf einen
Urkanal, der dem Kalium-Kanal sehr ähnlichg gewesen sein duerfte,
zurueckzufuehren.
Der Offenzustand des Natriumkanals ist durch eien Gatingsensor
(Spannungssensor) reguliert. Dieser trägt innerhalb seinder struktur
eine Ladung, die durch eine Spannungsänderung verschoben wird und so
die Konformation des Kanals ändert.
Durch das Verschieben der positiven Ladung innerhalb des Kanals von
der Innen- zur Aussenseite entsteht ein winzig kleiner Gating-Strom,
der auf Grund der geringen Amplitude allerdings nur bei geschlossenem
Kanal messbar ist.
Die Selektivität des Kanals wird durch eine COO--Aminosäuregruppe
in der Pore geregelt. Diese entfernt die Wasserhülle und erleichtert
so den Durchgang von Natrium.
Der Natriumkanal ist aus einer 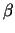 1-, einer 1-, einer 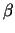 2- und einer 2- und einer
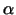 -Untereinheit aufgebaut. Die -Untereinheit aufgebaut. Die 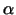 -Untereinhaeit enthält die
REpeat I bis IV von jeweils 150 Aminosäuren Länge, die wiederum in
sechs Transmembrandomänen S1 bis S6 und eine hydorophobe Domäne, die
in die Membran eintaucht, untergliedert sind. Der Bereich S4 ist für
die Spannungsabhängigkeit verantworltlich, die Repeats RIII und RII
für die Inaktivierung. -Untereinhaeit enthält die
REpeat I bis IV von jeweils 150 Aminosäuren Länge, die wiederum in
sechs Transmembrandomänen S1 bis S6 und eine hydorophobe Domäne, die
in die Membran eintaucht, untergliedert sind. Der Bereich S4 ist für
die Spannungsabhängigkeit verantworltlich, die Repeats RIII und RII
für die Inaktivierung.
Der Natriumkanal ist durch folgende Gift zu blockieren:
- Tetrodoxin aus dem Kugelfisch
- Saxitoxin aus einem Dinoflagellaten
- Batrachotoxin aus Pfeilgiftfröschen
Nikotinischer Acetylcholinrezeptor
Bei dem nikotinischen ACh-Rezeptor muss man zwischen einem adulten und
einem embryonalen Typ unterschienden. Der embryonale Rezeptortyp
bildet sich auch dann, wenn ein Muskel denerviert ist und verdrängt
dort den adulten Typ.
Dadurch, dass der Kanal nach einer durchschnittlichen Öffnungzeit von
1,4 ms immer eine Pause von 30 s einlegt, entstehen Serien von
sogenannten ,,bursts``.
Der Rezeptor besteht aus mehreren Untereinheiten: 2 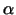 - und je
einer - und je
einer 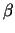 -, -, 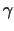 - und - und 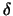 -Untereinheit. Jede dieser
Untereinheiten besteht aus vier Transmenmbrandomänen. Am
Aminoende einer -Untereinheit. Jede dieser
Untereinheiten besteht aus vier Transmenmbrandomänen. Am
Aminoende einer 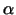 -Untereinheit kann je ein ACh binden. Die
Bindungssstellen sind mit denen für -Untereinheit kann je ein ACh binden. Die
Bindungssstellen sind mit denen für  -Bungarotoxin identisch. -Bungarotoxin identisch.
Der Rezeptor besitzt mehrere Zustände: Von dem Ausgangszustand kann
der Rezeptor ein ACh binden; von diesem R-ACh-Zustand aus kann er dann
ein zweites ACh binden und wird zu R-2ACh. Erst aus diesem Zustand heraus
kann sich der Kanal öffnen. Alle Übergänge zwischen den Zustängen
kinetische kontrolliert. Aus diesem Grund bricht der burst nach 2
Öffnungen des Kanals ab, da sich das ACh dann mit höherer
Wahrscheinlichkeit wieder vom Rezeptor löst.
Sehr wahrscheinlich wird bei einer Verwendung von ACh als Transmitter
ATP als Cotransmitter ausgeschüttet.
Der Kanal ist wenig selektiv und auch für Calcium und kleine
organische Ionen durchlässig.
Der nikotinische ACh-Rezeptor ist durch folgende Gifte zu
beeinflussen:
- Curare wirkt auf Grund von kompetitver Hemmung; es
konkurriert mit ACh um die gleiche Budnungsstelle. Es ist ein
partieller Antagonist, d.h. es bindet zwar, hat aber nicht den
ACh-Effekt.
 - Bungarotoxin hingegen ist ein irreversibler
Antagonist. Es bindet irreversibel an den Rezeptor. - Bungarotoxin hingegen ist ein irreversibler
Antagonist. Es bindet irreversibel an den Rezeptor.
- Kokain ist ein allosterischer Blocker, der anderer Stelle als
ACh an den Kanal bindet und diesen verschliesst.
Muskarinischer Acetylcholinrezeptor
Der Muskarinische ACh-Rezeptor hat - im Gegensatz zum Nikotinischen,
wo der Antagonist Nikotin ist - Muskarin oder Atropin, das Gift der
Tollkirsche als Antagonisten.
Eine wichtige Rolle spielt dieser Rezeptor bei der Hemmenden Wirkung,
die die Herzfrequenz auf Grund einer ACh-Ausschüttung des Nervus vagus
herabsetzt. Diese Hemmung erfolgt durch das Öffnen von
K(ACh)-Kanälen.
Die Aktivierung des Muskarinischen ACh-Rezeptors erfolt mit 30-100 ms
für einen G-Protein vermittelten Mechanismus sehr schnell, was darauf
zurückzuführen ist, dass hier das G-Protein direkt mit dem Kanal
interagiert.
Glutamat-gesteuerte Kanäle
Glutatmat ist der wichtigste exitatorische Transmitter im Gehirn.
Es gibt unterschiedliche, durch Glutamat gesteuerte Kanäle.
Dieser Typ besitzt eine hohe Leitfähigkeit, wird schnell
desensitiviert und erholt sich schnell.
Man hat diesen Kanal vor allem bei der Muskulatur von Heuschrecken und
Krebsen untersucht.
Die schnelle Desensitivierung beschränkt die Dauer der synaptischen
Ströme. Dies ist vor allem deshalb wichtig, da der Kanal auch für
Ca2+ durchlässig ist und sonst das Calcium-Gleichgewicht der
Zelle gestört würde.
Dieser Kanal wird durch CNQX gehemmt.
Der Kainat-Typ wird von Kainat und AMPA aktiviert und findet sich im
ZNS der Vertebraten. Er desensitiviert langsamer und es gibt auch
nicht desensitivierende Untertypen.
Wie auch der Quasiqualat-Typ ist der Kainat-Typ ein Kationenkanal mit
einer geringen Leifähigkeit von weniger als 20 pS. Die Kanäle sind für
Natrium und Kalium, nicht jedoch für Calcium permeabel.
Der NMDA-Rezeptor öffnet sich langsam und desenitiviert nicht oder
langsam. Er öffnet sich nur bei positiven Potentialen und besitze
einen spannungsabhängigen, konstitutiven Magnesiumblock.
Der NMDA-Kanal ist ein für Natrium, Kalium und Calcium permeabler
Katienonenkanal, der eine Leifähigkeit von ca. 50 pS aufweist. Durch
den Calciumeinstrom werden zusätlich Second Messender aktiviert, die
zu einer synaptischen Modifikation führen können.
Der Kanal öffnet sich nur, wenn Glycin vorhanden ist (???).
Der Kanal ist Glutatmat- und spannungabhängig. Normalerweise ist er
durch den Magnesiumblock blockiert; doch wird dieser durch eine
Depolarisation entfernt. Wenn dann Glutamat bindet, kommt es zu einer
höheren Depolarisation.
Das bedeutet, dass der NDMS-Rezeptor immer erst dannn aktiv wird, wenn
ein anderer Glutamat-Rezeptor bereits eine Depolarisation erzeugt
hat. Primär verstärkt der Rezeptor eine bereits vorhandene Antwort.
GABA-gesteuerte Kanäle
Die von GABA (Gamma-Amino-Buttersäure) angesteuerten Kanäle sind
permeabel für Chloridionen und besitzen mehrere Leitfähigkeitsniveaus
(22, 44 oder 33 ps), zwischen denen der Kanal - in Abhängigkeit von
der Konzentration - wechselt: je höher die Konzentration, desto höher
die Leitfähigkeit.
Die GABA-gesteuerten Kanäle binden Benzodiazeptine wie Valium und
Barbiturate, die die Wirkung von GABA verstärken und anstlösende
Wirkung haben. GABA, Benzodiazeptine und Barbiturate binden an
unterschiedlichen Stellen.
GABA wirkt als hemmender Transmitter auf unterschiedliche Rezeptoren:
- Der GABAA-Rezeptor (welcher auch Glycin-sensitiv ist) ist
eine ionotropher Rezeptor, der für einen Cl--Ausstrom sorgt.
- Der GABAB-Rezeptor wirkt metabotorph über Second Messenger
auf die Öffnung von Kaliumkanälen.
Glycinerge Kanäle
Die Kanäle sind von Struktur und aufbau den GABA-gesteuerten Kanälen
sehr ähnlich. Die werden durch Strycnin als Antagonisten blockiert.
|





