Unterabschnitte
Second messenger
Es gibt zwei Möglichkeiten, einen Kanal indirekt zu beeinflussen. Zum
einen kann dies direkt über G-Protein-gekoppelte Rezeptoren oder über
Rezeptortyrosinkinasen geschehen.
Generell ist die Aktivierung über einen Botenstoff (Second Messenger)
zwar langsamer, hat jedoch einer langfristigere Wirkung
G-Proteine sind prinzipiell aus drei Untereinheiten aufgebaut: 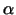 ,
, 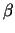 , und , und 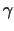 . Die . Die 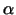 -Untereinheit ist nur locker mit der
Membran assoziiert und sorgt für die Kopplung zwischen Rezeptor und
primärem Effektor: Nachdem der Transmitter gebunden hat, tauscht die -Untereinheit ist nur locker mit der
Membran assoziiert und sorgt für die Kopplung zwischen Rezeptor und
primärem Effektor: Nachdem der Transmitter gebunden hat, tauscht die
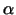 -Untereinheit das von ihr gebundene GDP gegen ein GTP aus und
diffundiert durch die Membran, bis es auf den sekundären Effektor
trifft. Dieser wird aktiviert und die -Untereinheit das von ihr gebundene GDP gegen ein GTP aus und
diffundiert durch die Membran, bis es auf den sekundären Effektor
trifft. Dieser wird aktiviert und die 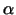 -Untereinheit deaktiviert
sich selbst, indem sie das GTP zu GDT hydrolysiert und wieder an die
beiden anderen Untereinheiten bindet. -Untereinheit deaktiviert
sich selbst, indem sie das GTP zu GDT hydrolysiert und wieder an die
beiden anderen Untereinheiten bindet.
Durch Gabe von schwefelsubstituiertem GTP, kommt es zu einer
dauerhaften Bindung mit der 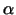 -Untereinheit, was den Effektor
entweder blockiert oder dauerhaft aktiviert. -Untereinheit, was den Effektor
entweder blockiert oder dauerhaft aktiviert.
Für das Resultat eines G-Protein-gekoppelten Mechanismus gibt es
mehrere Möglichkeiten: Zunächst kann entweder das G-Protein einen
Rezeptor direkt beeinflussen, oder diese Beeinflussung läuft über
einen der unten genannten Mechnismen und eine Phosphorylierung. Der
erste Mechanismums ist schneller, der letztere dagegen von längerer
Wirkung und besser steuerbar:
Die Phosphorylierung kann einen Kanal nich nur öffnen oder schliessen,
sondern auch dessen Empfindlichkeit beeinflussen; ausserdem kann durch
die Phosphorylierung von Proteinen, die an der Genexpression beteiligt
sind, eine langfristige Änderung eingeleitet werden.
Neben den unten genannten Second Messenger hat man ausserdem für cGMP
(vor allem im Sehsystem) und für Kohlen- (CO) und Stickstoffmonoxid
(NO) eine Wirkung als Second Messenger gefunden.
Vor allem NO ist ein interessante Second Messenger, da er Reaktionen auch
zwischen Zellen vermitteln kann. NO wirkt als Relaxationsfaktor, indem
er die Guanylatcyklase zur Bildung von cGMP stimuliert und so z.B. zu
einer Relaxation der Myofibrillen führt.
NO wird durch die NO-Synthase aus Arginin synthetisiert. Die
NO-Synthase kann durch Calmodulin regulier werden; sie wird bei einer
Konzentration von ca. 1mol/l aktiv.
Ihre Wirkung entfalten CO und NO durch Bindung an eine Häm-Gruppe
bestimmter Proteine.
cAMP
Bei einem cAMP-abhängigen Weg laufen folgende Schritte ab:
- Der Transmitter bindet an den Rezeptor.
- Ein Stimulatisches G-Protein wird aktiviert.
- Das G-Protein (genauer: die
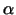 -Unterinheit) bindet GTP
statt, GDP. -Unterinheit) bindet GTP
statt, GDP.
- Das G-Protein stimuliert die Adenylatcyklase.
- Diese wandelt ATP in cAMP um.
- Das G-Protein hydrolysiert GTP zu GDP, fällt dadurch von der
Adenylatcyklase ab.
- Die cAMP-Produktion wird gestoppt.
- cAMP aktiviert eine Proteinkinase, indem es die regulatorische
Untereinheit dieses Proteins von der katalytischen trennt:
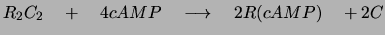
- Diese Untereinheiten phosphorylieren ihre Substrate unter
ATP-Verbrauch. Die Kinase erkennt ihr Substrat über die
Phosphorylierungssequenz. Bei der cAMP-abhängigen Proteinkinase ist
diese z.B. «Arg - Arg - beliebig - Ser ».
- Durch eine eventuelle Autophosphorylierung kann die
regulatorische Untereinheit so phosphoryliert werden, dass auch nach
Abnahme des cAMP-Spiegels die Untereinheiten erst langsam wieder
aneinander binden.
Unabhängig von diesem Weg besteht ausserdem die Möglichkeit, dass das
cAMP direkt die Proteinkinase A aktiviert, indem 4 cAMP an die
regulatorische Untereinheit binden und so die katalytische
Untereinheit aktivieren. Diese kann dann eine Calciumkanal oder den
Transkriptionsapparat phosphorylieren.
Inositoltriphosphat (IP3)
Der Mechanismus, der IP3 als Signalmolekül verwendet läuft wie folgt
ab:
- Über einen G-Protein-gekoppelten Mechanismus werden die
Phospholipasen C und A2 (in der Membran sitzend) aktiviert.
- Die Pholpholipase C katalysiert folgende Reaktionen:
- Über weitere Kaskaden kann IP3 zu IP4 und IP5 werden.
- Durch das DAG wandert die Proteinkinase C in die Membran und
wird dort aktiviert.
- Die Proteinkinase C erzeugt weiteres IP3 und DAG.
- Das IP3 erhöht die Calciumkonzentration der Zelle, indem das
endoplamatische Retikulum Calcium freisetzt.
- Das Calcium bindet an Calmodulin.
- Das veränderte Calmodulin aktiviert die CaM-Kinase II.
- Die ebenfalls aktivierte Phospholiase A2 (siehe oben) verwandelt
Phosphatidylinositol in Archidonsäure.
- Durch weitere Modifikation der Archidonsäure und dere Abbau
werden weitere Signalwege ausgelöst. Da sie fettlöslich ist, kann
sie auch in andere Zellen einwandern und ihren Effekt dort ausüben.
Tyrosinkinasen
Tyrosinkinasen besitzen nur eine Transmembrandomäne. Im
extracellulären Raum können sie Peptide, wie z.B. EGF oder NGF
binden. Die Kinase wird nur dann aktiv, wenn zwei Liganden binden.
Dies hat zur Folge, dass sich ein Dimer aus 2 REzeptoren bildet und
diese sich zunächst wechselseitig autophosphorylieren. Dann folgt an
der cytoplamatischen Domäne eine Phosphyorylierung von Tyrosinresten.
So werden Proteine beeinflussst und vor allem durch das
phosphorylieren von anderen Kinasen kann der Effekt exponentiell
verstärkt werden.
|





