Unterabschnitte
Das Cytoskelett
Die Elemente des Cytoskeletts lassen sich in mehrere Klassen
unterteilen:
- Aktin
- Mikrotubuli
- Intermediärfilamente
Die Aktinfasern bilden Bündel aus. In Gewebekulturzellen kann man
Stressfasern aus Aktin beobachten, die für die Ausbreitung der Zellen
auf der Oberfläche verantwortlich sind.
Seine Kraftwirkung entfaltet Aktin durch Wechselwirkungen mit Myosin.
Die Aktinfasern bilden bei der Zellteilung (siehe
2.3.4) einen kontraktilen Ring, der die Tochter- von
der Mutterzelle abschnürt.
Die Mikortubuli sind aus zwei Untereinheiten (einer  - und
einer - und
einer 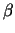 -Tubulin) aufgebaut. Diese bilden Dimere, die sich zu
Protofilamenten zusammenlagern. Dreizehn dieser Protofilamente bilden
einen Hohzylinder aus. -Tubulin) aufgebaut. Diese bilden Dimere, die sich zu
Protofilamenten zusammenlagern. Dreizehn dieser Protofilamente bilden
einen Hohzylinder aus.
Die Mikrotubuli wachsen durch Anlagern von Tubulin-Dimeren an den
Enden weiter. Das Wachstum geht von einem Mikrotubuli-organisierenden
Zentrum (MTOC) aus. Das Gleichgewicht zwischen Auf- und Abbau wird
durch die Mikrotubuli-assoziierten Proteine (MAP) geregelt.
Alle drei Arten von Filamenten sind untereinander verbunden und
interagieren miteinander. Durch ein zusammenwirken von MT und Aktin
kommt es zu einer Polarität der gesamten Zelle. Diese ist z.B. bei der
Ausschüttung cytotoxischer Substanzen durch T-Zellen besonders
ausgeprägt. Die Zelle bewegt ihr Centrosom und damit auch den
Golgiapparat mit den cytotoxischen Substanzen auf die zu tötendes
Zelle zu.
Aktin
Während die MT im Allgemeinen als einzelne Stränge agieren, formen die
Aktinfilamente eine Netzwerk. Unterhalb der Plasmamembran bildet das
Aktin ein Netzwerk aus, das auch als Zellrinde bezeichnet wird. Das
Aktin kann die Plasmamembran nach aussen ausstülpen oder nach innen
einziehen (z.B. bei der Zellteilung) und reguliert auf diese Art die
Oberfläche. Experimente an Keratozyten (nicht pigmentierte Zellen der
Fischuppe) haben gezeigt, dass das Aktin allein ebenfalls in der Lage
ist, eine Zelle zu bewegen.
Aktin besteht aus zu einer Helix gewundenen Einheiten aus identischem
globulären oder G-Aktin.
Wie auch die MT haben die Aktinfilamente eine polare Struktur, die
sich in einem schnell wachsenden (+)- und einem langsam wachsenden
(-)-Ende ausdrückt. Im Gegensatz zu den MT, wo das (+)-Ende drei mal
schneller polymerisiert als das (-)-Ende polymerisiert beim Aktin das
(+)-Ende bis zu zehn mal schneller.
Bei allen höheren Eukaryonten kann man bis zu
sechs Aktinformen unterscheiden, die sich anhand ihres isoelektrischen
Punktes in mehrere Klassen einteilen lassen. Die  -Aktine kommen
vor allem in Muskelgewebe, die -Aktine kommen
vor allem in Muskelgewebe, die 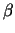 - und - und 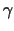 -Aktine vor allem
in Nicht-Muskelzellen vor. -Aktine vor allem
in Nicht-Muskelzellen vor.
Zur Polymerisation benötigt das Aktin ATP sowie ein- und zweiwertige
Ionen; in der Regel Kalium und Magnesium. Auch beim Aktin kann man in
vitro nach einer relativ langsamen Aufbauphase eine schnelle
Polymerisation, die dann in ein Gleichgewicht übergeht beobachten.
Da die Geschwindigkeit der Neubildung von Filamenten proportional der
dritten Potenz der Aktinkonzentration ist, nimmt man an, dass der
Ausgangspunkt für die Polymerisation ein Trimer ist.
Bei der Polymerisation und Depolymerisation des Aktin verläuft analog
zu den MT. Die Hydrolyse des ATP ist nicht für den Aufbau der Polymere
verantwortlich, sondern destabilisiert die Filamente und führt so zu
deren Abbau.
Eine dynamische Instabilität wie bei den MT kann man beim Aktin nicht
beobachten. Man findet aber einen sogenannten Tretmühlmechanismus, bei
dem am (+)-Ende stetig Aktin auf und am anderen Ende abgebaut wird, so
dass sich die Gesamtlänge des Filaments allerdings nicht ändert.
Cytochalasine binden an das Ende des Aktins und verhindern das weitere
Polymerisieren und wird z.B. bei der Untersuchung von Zellbewegungen
benutzt. Die Phalloidine stabilisiern der Aktin gegenüber der
Depolymerisation und binden an das Aktin, so dass man sie zur Färbung
verwenden kann.
Die Polymerisation des Aktins wird von der Zelle durch Proteine
gesteuert. Das Thymosin ist ein kleines Molekül, das an das Aktin
bindet und so dessen Polymerisation verhindert. Das Profilin wird von
der Zelle zur Steuerung der Polymerisation auf äussere Reize hin
benutzt. Es stimuliert den Austausch von ADP gegen ATP und fördert so
die Polymerisation. Des weiteren gibt es auch einige Proteine, die
sich an das Aktin anlagern und die Bildung von Filamenten hemmen.
Das Aktin spielt auch eine entscheidende Rolle bei der Ausbildung von
Pseudopodien und Mikrospikes (relativ lange, dünne, steife
Auswüchse). Im Inneren der Mikrospikes liegen Bündel aus ca. 20
Aktinfilamenten, die mit ihrem (+)-Ende nach aussen orientiert sind.
Bei den Pseudo- oder Lamellipodien handelt es sich quasi um mehrere
nebeneinander liegende Mikrospikes. Dabei organisiert der Leitsaum die
Aktinfilament. Zur Art der Forbewegung gibt es zwei unterschiedliche
Modelle. Eines besagt, dass die Filamente an der zum Kern gerichteten
Seite depolymerisieren und an der Front polymerisieren und so die
Zelle nach vorne schieben. Das Kembildungs-Freisetzungsmodell
postuliert hingegen, dass bei der Neubildung von kurzen Aktin-Strängen
sich diese nach vorne schieben und dabei die ehemalige vorderste Front
nach hinten drängen.
Das Bakterium Listeria monocytogenes nutzt das Aktin für seinen
eigenen Transport. Nach seinem Eindrigen in die Zelle exprimiert es
Proteine an seiner Oberfläche, die das Aktin dazu veranlassen, das
Bakterium innerhalb der Zelle und - über Mikrospikes - auch in
andere Zellen zu transportieren.
Die Steuerung der Aktinpolymerisation wird von vielen Zellen mit
Chemotaxis verwendet. Bei den neutrophilen Granulocyten beispielsweise
sorgen Oberflächenrezeptoren dafür, dass sich das Aktin so verändert,
dass eine Chemotaxis in Richtung auf das von Bakterien im Stoffwechsel
freigesetzt N-Formylmethionin entsteht. Dabei wird der Leitsaum so
organisiert, dass er sich dem Stoff zuwendet. Dazu lösen sich die
Zellen zunächst von dem Untergrund und strecken dann Aktinreiche
Fortsätze aus.
Man nimmt an, dass die Wirkung zwischen dem G-Protein-gekoppelten
Rezeptor über zwei keine GTPasen Rho und Ras umgesetzt und am Ende das
Profilin auf der Membran freisetzt. Dieses führt dann zu einer
Vermehrten Polymerisation des Aktins.
Durch quervernetztende Proteine ist das Aktin in unterschiedlichen
Bereichen unterschiedlich geformt:
In den Filopodien und Mikrospikes sind die Aktinbündel parallel
orientiert und gleich ausgerichtet. Diese Fasern werden Parallelbündel
genannt.
In Stressfasern und im kontraktilen Ring findet man kontraktile
Bündel, in denen die Filamente mit entgegengesetzter Polarität
angeordnet sind und Myosin II enthalten.
In dem Gelartigen Geflecht der Zellrinde sind die Filamente relativ
locker und offen angeordnet und bilden ein Netzwerk.
Man unterscheidet die Proteine nach ihrer Wirkung in vitro in zwei
Gruppen unterteilen:
Die Bündelungsproteine koppeln die Aktinfasern in einer parallelen
Anordnung.
Das Fimbrim ist vermutlich für die Bildung von Mikrospikes und
Filopodien verantwortlich, während das  -Aktinin sich vor allem
in den Stressfasern befindet und es trägt dazu bei, die Stressfasern
an den Fokalkontakten zu befestigen. -Aktinin sich vor allem
in den Stressfasern befindet und es trägt dazu bei, die Stressfasern
an den Fokalkontakten zu befestigen.
Sehr wahrscheinlich werden die Bündel durch das Fimbrin so dicht, dass
das Myosin aus den Bündeln herausgehalten wird, während das
 -Aktinin eine lockere Bündelung und damit die Kontraktilität
durch das Eindringen von Myosin erzeugt. -Aktinin eine lockere Bündelung und damit die Kontraktilität
durch das Eindringen von Myosin erzeugt.
Die Gel-bindenden Proteine fördern die Quervernetztung des Aktins.
Das Filamin bindet in Form eines Homodimers zwei Akinfasern, die sich
dadurch im rechten Winkel überkreuzen und erzeugt so ein lockeres,
sehr viskoses Netzwerk.
Da sie eine hohe Homologie, vor allem in den Bindungsdomänen,
aufweisen nimmt man an, dass alle Aktin-bindenden Proteine aus einem
einzigen Vorläufer entstanden sind.
Neben dem Filamin ist vor allem das Gelsolin für die Konsistenz eines
Aktin-Netzwerks verantwortlich. Dieses Enyzm wird bei relativ hohen
Calciumkonzentrationen aktiv und durchtrennt dann die
Aktin-Filamente. Dieser Mechanismus ist auch dafür verantwortlich,
dass dich das Aktinskelett - z.B. bei der Phagozytose - auflöst und
das Phagosom mit den Lysosomen verschmelzen kann.
Auch beim Aktin sind für die meisten Bewegungen Motorproteine
verantwirklich. Alle Motorproteine, die mit dem Aktin assoziiert sind
gehören zur Familie der Myosine.
Das am besten charakterisierte Myosin ist das Myosin II der
Muskelzellen. Das Myosin II hat immer zwei Köpfchen, die sowohl
ATPase, als auch Bewegungsaktivität aufweisen. Der Kopf wird von der
aminoterminalen Seite gebildet. Der carboxyterminale Teil liegt als
 -Helix vor und kann mit einer weiteren schweren Kette
dimerisieren. Durch diese Dimerisierung ist es möglich, dass sich zwei
Aktinfasern aneinandern vorbei bewegen. -Helix vor und kann mit einer weiteren schweren Kette
dimerisieren. Durch diese Dimerisierung ist es möglich, dass sich zwei
Aktinfasern aneinandern vorbei bewegen.
In Nicht-Muskelzellen findet man vor allem das Myosin I mit einer
Motordomäne (Kopf) und einem Schwanz, der entweder an eine Membran
oder einen anderen Aktinstrang bindet.
Bei der Bildung des kontraktilen Rings während der Zellteilung wandern
die Myosin II-Moleküle in die Äquatoreregion, führen zur Teilung der
Zelle und verteilen sich danach wieder gleichmässig.
Alle Myosine bewegen sich durch ATP-Hydrolyse von (-)- zum (+)-Ende
des Aktins.
Stressfasern bilden sich bei Zugkräften ebenfalls unter Beteiligung
des Myosins.
Die Stressfasern setzen an den Fokalkontakten an, wo sie indirekt mit
der Extrazellulären Matrix verbunden sind.
Die Integrine binden extrazellulär an die Firbronectin-Matrix. An
ihrer intrazellulären Domäne wird über einen Komplex aus
Anheftungsmolekülen (Talin, Vinculin, Paxillin und  -Aktinin)
mit dem Aktin verbunden. -Aktinin)
mit dem Aktin verbunden.
In den Mikrovilli, die z.B. im Darm der Vergrösserung der Oberfläche
dienen, liegt das Aktin in einer ähnlichen Parallelfaserstruktur wie
in den Mikrospikes vor - nur ist hier nicht das Fimbrin, sondern das
Villin für die Verbingung der Aktinfilamente verantwortlich. Durch ein
amorphes Gemisch aus Spektrinen und Intermediärfilamenten bindet das
Aktin im apikalen Bereich und richtet sich somit rechtwinklig zur
Zelloberfläche aus. Durch das membrangebundene Myosin I ist das Aktin
der Mikrovilli mit der Membran verbunden. Man vermutet, dass das
Myosin I eventuell die Membran aktiv nach oben zieht.
Das Tropomyosin bindet als ein Dimer über die gesamte Länge des Aktins
und stabilisiert es so. Es verhindert die Bildung von Filamin und
verstärkt die Bindung von Myosin II. Durch weitere Wechselwirkungen
zwischen den Proteinen und der Kontraktion der Aktinfasern kommt es
dann dazu, dass sich die Strukturen der Stressfasern und des
gelartigen Netzwerkes getrennt von einander in der selben Zelle
ausbilden können.
Man kann die Veränderungen des Aktins in drei Phasen unterteilen: Die
erste Phase ist das Ausstülpen der Lamellipodien, danach folgt das
Anheften an die Unterlage und schliesslich der Zug, der die Zelle
bewegt.
Durch Polymerisation des Aktins stülpt sich der Leitsaum nach
vorne. Andere Theorien besagen, dass entweder an der Membran
verankerte Myosin-Moleküler oder der in anderen Teilen der Zelle
erzeugte hydrostatische Druck für das Ausstülpen der Membran
verantwortlich sind.
Die Anheftung an die Oberfläche geschieht vermutlich ähnlich wie bei
der Aubildung der Fokalkontakte.
Der Zug ist bisher nur ungenügend geklärt. Man vermutet, dass er
eventuell das Resultat von Aktinpolymerisation ist - ist sich aber
nicht sicher.
Mikrotubuli
Die MT sind gerichtete Strukturen mit eine (+)- und einem (-)-Ende,
wovon nur das (+)-Ende zu einem raschen wachstum in der Lage ist. Die
(-)-Enden sind in den meisten Zellen mit dem Centrosom (in der Nähe
des Zellkerns) verbunden. Die (-)-Enden sind durch den Centromer
stabilisiert und die (+)-Enden können sich zur Peripherie hin variabel
ausbreiten.
Die MT bestehen aus Tubulin-Molekülen. Jedes Tubulin ist ein
Heterodimer aus einem  - und einem - und einem 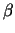 -Tubulin. In einem
Mikrotubulus sind diese Heterodimer dann zu Protofilamenten
polymerisiert, welche eine Röhre - den MT - bilden. -Tubulin. In einem
Mikrotubulus sind diese Heterodimer dann zu Protofilamenten
polymerisiert, welche eine Röhre - den MT - bilden.
Die MT sind immer in einem Gleichgewicht zwischen Wachsen und
Abbau. Besonders deutlich wird dies bei der Mitose, wo die MT die
Mitosespindel neu bilden. Aus diesem Grund lässt sich die Mitose auch
mit Colchicin hemmen: Colchicin verhindert einen weiteren Aufbau der
Mitosespindel.
Wenn man die MT mit Colcemid zerstört und anschliessend neu wachsen
lässt, dann erhält man eine kleine sternförmige Struktur - die
Astere. Die Astere entwickelt sich weiter und ihr Zentrum wird zum
Centrosom. Dieses teilt sich in der Interphase in zwei Centriolen und
bildet die Mitosespindel.
Das Centrosom wird durch eine Mischung verschiedener Proteine -
darunter das 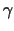 -Tubulin in Form einer Centrosomen-Matrix
gebildet, an der dann die MT ihre Polymerisation mit dem (-)-Ende
beginnen. -Tubulin in Form einer Centrosomen-Matrix
gebildet, an der dann die MT ihre Polymerisation mit dem (-)-Ende
beginnen.
Man hat die Polymerisation der MT in vitro untersucht und konnte dabei
feststellen, dass es ein relativ langsamer Prozess ist, bis sich ein
MT neu gebildet hat, dieser dann aber realtiv schnell wächst und dann
nach einiger Zeit ein Gleichgewícht erreicht, indem der Aufbau von
neuem Tubulin im Gleichgewicht mit dem Abbau des MT steht.
In der Zelle liegen etwa 50% des Tubulins in freier und der gleiche
Anteil in den MT vor. Die Anlagerung des Tubulins erfolgt am (+)-Ende
drei Mal schneller als am (-)-Ende.
Man findet in der Zelle wie in vitro bei den MT eine dynamische
Instabilität. Dieser Mechanismus ist durch die Hydrolyse von GTP
gesteuert. Wenn das 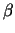 -Tubulin ein GTP gebunden hat, binden
weitere Heterodimere leichter an das bestehende Protofilament. Wenn
die Polymerisationsgeschwindigkeit hingegen abnimmt, wird es
wahrscheinlicher, dass das GTP hydrolysiert, wodurch die die Dimere
nach und nach lösen und es zur Depolymerisation kommt.
Die Zelle kann diesen Prozess steuern, indem sie entweder - wie bei
der ausdifferenzierten Zelle, die eine äussere Form annimmt - die MT
durch Proteine stabilisiert oder deren dynamisch Instabilität in der
M-Phase erhöht. -Tubulin ein GTP gebunden hat, binden
weitere Heterodimere leichter an das bestehende Protofilament. Wenn
die Polymerisationsgeschwindigkeit hingegen abnimmt, wird es
wahrscheinlicher, dass das GTP hydrolysiert, wodurch die die Dimere
nach und nach lösen und es zur Depolymerisation kommt.
Die Zelle kann diesen Prozess steuern, indem sie entweder - wie bei
der ausdifferenzierten Zelle, die eine äussere Form annimmt - die MT
durch Proteine stabilisiert oder deren dynamisch Instabilität in der
M-Phase erhöht.
In der polymerisierten Form können die MT durch Modifikationen
verändert werden: Ein bestimmter Lysinrest des  -Tubulins kann
acetyliert oder ein Tyrosin am Carboxyende entfernt werden. Beide
Reaktionen gehen sehr langsam vor sich und man findet um so mehr
Modifikationen, je länger die MT polymiersier sind.
Man kann auf Grund dieser Tatsache mit Antikörpern, die sich
spezifisch gegen die Modifikationen richten, die Stabilität der MT
nachweisen. -Tubulins kann
acetyliert oder ein Tyrosin am Carboxyende entfernt werden. Beide
Reaktionen gehen sehr langsam vor sich und man findet um so mehr
Modifikationen, je länger die MT polymiersier sind.
Man kann auf Grund dieser Tatsache mit Antikörpern, die sich
spezifisch gegen die Modifikationen richten, die Stabilität der MT
nachweisen.
Die Mikrotubulin-assoziierten Proteine (MAPs) dienen dazu, die MT zu
stabilisieren und Wechselwirkungen mit anderen Proteine zu
vermitteln.
Die MAPs dienen ausserdem dazu, die MT in bestimmten Zellbereichen zu
differenzieren. Besonders deutlich wird dies bei den Neuronen, wo sich
im Axon lange MT mit einem vom Zellkörper wegweisenden (+)-Ende finden
und in den Dendriten eine weniger geordnete Polarität und kürzere MT.
Dies wird durch induziert, dass ein kleines MAP, der Faktor tau in
einer bestimmten Form nur im Axon vorkommt, während das MAP2-Protein
nur in den Dendriten vorkommt. Des weiteren unterscheiden sich Axon
und Dendrit aber auch in mRNAs, Ionenkanälen und Ribosomen (nur in den
Dendriten vorhanden) und bestimmten Adhäsionsmolekülen und die am AP
beteiligten Natriumkanäle findet man nur im Axon.
Wenn man bestimmte Pigmentzellen aus Fischschuppen (an den MT sind
Pigmenrkörner befestigt, so dass der Fisch seine Farbe ändern kann)
isoliert und ein Stück davon abtrennt, so sind die MT direkt nach dem
Abtrennen des Zellstücks noch auf das ehemalige Centrosom hin
orientiert - später allerdings bildet sich in der Mitte des
Zellstücks ein neues Centrosom. Durch diese Untersuchungen geht man
davon aus, dass sich das Centrosom immer in der Mitte der Zelle bildet
und somit diese markiert.
Die MT dienen Motorproteinen als Schienen, an denen sich diese entlang
bewegen. Man kann diese in zwei Klassen unterteilen: Das Kinesin
wandert zum (+)-Ende; die Dyneine bewegen sich in entgegengesetzer
Richtung.
Die cytoplasmatischen Dyneine sind am Transport der Organellen und an
der Mitose beteiligt.
Die Kinesine wirken bei unterschiedlichen Transportmechanismen mit:
Organellentransport, Mitose, Meiose und Transport der sekretorischen
Vesikel.
Beide Proteine bestehen aus zwei schweren und mehreen leichten
Ketten. Jede der schweren Ketten ernhält einen Kopf, der ATP bindet
und einen Schwanz aus stäbchenförmigen Domänen. Durch die Bindung des
Schwanzes wird bestimmt, was transportiert wird, während der Kopf als
ATPase der Motor des Transports ist.
Cilien sind haarähnliche Fortsätze mit einem Bündel von MT in ihrem
Inneren. Sie dienen der Fortbewegung oder dazu um Flüssigkeit über die
Zelloberfläche zu bewegen. Die Flagellen, mit denen sich die
Samenzellen und einfache Protozoen fortbewegen sind normalerweise
deutlich länger als die Cilien, sind in der Struktur ähnlich;
allerdings führen sie keine peitschenartigen, sondern sinusförmige
Wellen aus.
Die Bewegung der Cilie entsteht durch eine Bewegung ihres Axonems, des
inneren vollständig aus MT bestehenden Kerns. Die Struktur des Axonems
besteht aus neun Doppel-MT, die um zwei einzelne MT in Zentrum
angeordnet sind. Diese ,,neun-plus-zwei-Anordnung`` ist
charakteristisch für fast alle Cilien und Eukaryonten-Flagellen. Die
inneren MT sind vollständig, wohingegen die Doppel-MT aus je einem
vollständigen und einem unvollständigen MT bestehen. Der
unvollständige MT benutzt einen Teil der Wand des anderem MT mit.
Der Antrieb der Cilienbewegung kommt durch die mit den MT assoziierten
Proteine zustande - vor allem durch das Cilien-Dynein. Durch dieses
Protein, das grösser ist als das im Cytoplasma verwendete Dynein,
werden die MT aneinandern vorbeibewegt. Da die MT über Querbrücken
miteinander verbunden sind, kommt es nicht zu einem freien Gleiten,
sondern zu einer Krümmung des gesmaten Apparates. Der Schwanz des
Dyneins bindet immer nur an den A-, nicht aber an den B-Tubulus. So
wird die Bewegung synchronisiert und ein gegenseitiges ,,
Tauziehen`` zwischen benachbarten MT wird vermieden.
Die Cilien gehen von einem sogenannten Basalkörper aus. Dieser ist eng
mit dem Centrosom verwandt und organisiert die Bildung der MT. Bei
einigen Einzellern bildet sich die Cilien während der Mitose völlig
zurück; die MT werden Teil des Spindelapparates und organisieren sich
nach der Mitose neu.
Wie die Länge der Cilien reguliert wird ist nicht bekannt.
Die Neubildung der Basalkörper beruht auf einer Verdoppelung der
vorhandenen Basalkörper - so wie die Centriolen eines Centrosoms
ebenfalls durch Verdoppelung der vorhandenen Centriolen hervorgehen.
Intermediärfilamente
Die Intermediärfilamente haben ihren Namen daher, da ihr im EM
erkennbarer Durchmesser zwischen dem der Aktin- und der
Myosin-Filamente im Muskel - wo sie zuerst entdeckt wurden -
liegt. In Wirklichkeit liegt er aber zwischen dem der MT und des
Aktins.
Die Intermediärfilamente bilden die Kernlamina und in Zellen, die
besonderer mechanischer Belastung ausgesetzt sind (Muskeln, Nerven und
Epithel) helfen sie, diese mechanisch zu stabilisieren.
Die Intermediärfilamente bestehen aus einem aminoterminalen Kopf,
einer stabförmigen  -Helix in der Mitte und einem
carboxyterminalen Schwanz.
Bei der Helix findet man ein Motiv von Siebener-Wiederholungen, das
als Heptadem-wiederholung bezeichnet wird und durch lange
Tandem-Wiederholungen sehr leicht dimerisiert. -Helix in der Mitte und einem
carboxyterminalen Schwanz.
Bei der Helix findet man ein Motiv von Siebener-Wiederholungen, das
als Heptadem-wiederholung bezeichnet wird und durch lange
Tandem-Wiederholungen sehr leicht dimerisiert.
Aus diesen Filamenten bilden sich durch Dimerisierung sogenannte
Doppelwedel-Dimere (parallel ausgerichtet). Diese werden antiparallel
zu Tetrameren ausgerichtet. Diese Tetramere verbinden sich dann durch
Überlappungen zu einer schraubenartigen Struktur - den
Intermediärfilamenten.
Die Intermediärfilamente liegen in fast allen Zellen in einem
vollständig polymerisierten Zustand vor. Die Zelle kann ihre Struktur
jedoch durch Phosphorylierung steuern.
Die Hauptaufgabe der Intermediärfilamente besteht darin, mechanische
Belastungen von der Zelle abzuhalten. Durch ihre überlappende Struktur
können die Intermediärfilamente wesentlich höhere Dehnkräfte aushalten
als Aktin oder die MT.
Im Cytoplasma der Wirbeltiere findet man drei Typen von
Intermediärfilamenten:
- Keratin-Filamente
- Vimentin und vimentin-ähnliche Filamente
- Neurofilamente
Die Keratine bilden sich vor allem in den Epithelzellen. Man kann sie
in saure Keratine (Typ I) und neutrale oder basische Keratine (Typ II)
unterteilen. Die Keratine sind immer nur in der Lage, sich mit dem
anderen Keratintyp zu einem Heterodimer zu verbinden. Homodimere sind
nicht möglich. In einigen Zellen findet man Kombinationen von bis zu
sechs verschiedenen Keratinen.
Die Keratine bilden Haare, Nägel, etc. und sind in den Epithelzellen
an die Desmosomen, die benachbarte Zellen verbinden, gebunden.
Das Vimentin bilden Polymere aus einem einzigen Typ. Alle Unterarten
polymerisieren aber auch miteinandern - nicht jedoch mit der
Keratinen. Es ist der am weitesten verbreitete Typ von
Intermediärfilament.
Die Neurofilamente bilden den wichtigsten Teil des Axons und
stabilisieren dessen Cytoskelett.
Die Kernlamina besteht aus einer besonderen Art von
Intermediärfilamenten - den Laminen.
Diese haben eine etwas längere stabförmige Domäne in der Mitte, haben
ein Transportsignal, das sie in den Zellkern lenkt, lagern sich dort
dann zu einem Geflecht zusammen, das bei der Mitose durch
Phosphorylierung sehr leicht zerfällt und sich dann wieder neu
bildet. Man findet diese Elemente nur bei Vielzellern.
Zellteilung
Bei der Zellteilung wird da Chromatin zunächst dichter gepackt, bei
höheren Eukaryoten löst sich neben dem ER und dem Golgiapparat auch
die Kernhülle auf; das Cytoskelett dissoziiert und die Zellteilung
wird durch die Bildung des Spindelapparates aus Mikrotubulidimeren
eingeleitet.
Muskeln
Die Muskelfasern entstehen in der Entwicklung durch das Verschmelzen
vieler Einzelzellen zu einer Riesenzelle, die jedoch ihre Kerne behält
und unter der Plasmamembran anordnet. Der Hauptteil der Muskelzelle
besteht aus Myofibrillen - den Kontraktilen Elementen der Zelle.
Die Kontraktilen Einheiten sind die sogenannten Sarkomere, die durch
die dunklen Z-Streifen getrennt sind. Die dünnen Filamente aus Aktin
sind an den Z-Scheiben befestigt und verlaufen bis zur Mitte. Die
dicken Filamente aus Myosin II überlappen sich im Mittelteil mit den
Aktinfilamenten.
Die Aktinfilamente sind mit den (+)-Enden in den Z-Scheiben
verankert.
Die Struktur der Myofibrillen wird durch eine grosse Anzahl von
Proteinen aufrecht erhalten. Die beiden wichtigsten im Skelettmuskel
sind Titin und Nebulin. Das Titin erstreckt sich von den Z-Scheiben zu
den Myosinfibrillen und dient wohl in der Art einer Feder dazu, diese
in der Mitte zu halten. Nebulin erstreckt sich über die gesamte Länge
der Aktinfilamente und besitzt viele aktin-bindende Domänen. Man nimmt
an, dass Nebulin die Länge der Aktinfilamente kontrolliert.
Die Myofibirllen sind über Proteine an die Plasmamembran
gebunden. Eines dieser Proteine ist das Dystrophin, das bei einem
Defekt zu Muskelschwund führt.
Die Kontraktion kommt nach dem Gleitfasermodell durch eine
Verschiebung der beiden Fasern gegeneinander zu Stande. Diese beruht
auf einer cyclischen Anheftung und Bewegung der Myosinköpfe.
Zu Beginn des Zyklus ist das Myosin fest an das Aktin gebunden. Durch
Binden an ATP löst sich das Myosin vom Aktin. Nach der Hydrolyse des
ATP richtet sich der Myosinkopf auf und bindet an das Aktin. Durch die
Abgabe des abgespaltenen Phosphats wird die Kraft der Kontraktion
erzeugt, wobei das ADP sich ebenfalls löst und die Ausgangsposition
wieder hergestellt wird.
Wenn der Nerv ein Aktionspotential an die Muskelzelle weitergibt,
läuft das Signal entlang der Transversal-Tubuli (Membranfalten um die
Myofibrillen herum) und wird von dort auf das Sarkoplasmatische
Reticulum (SR) übertragen. Dadurch erfolgt eine Calciumfreisetzung aus
dem SR.
Das Calcium bindet an die C-Untereinheit (C für Calciumbindend) des
Troponins. Dadurch wird die I- (Inhibierende) Untereinheit von der
Aktin-Myosin-Bindungsstelle, so dass die Kontraktion stattfinden
kann. Neben diesen beiden Untereinheiten besitzt das Troponin noch
eine weitere Untereinheit, mit der es an das Tropomyosin bindet
(T-Untereinheit).
Beim Herzmuskel sind die Zellen nicht verschmolzen. Die Einzelzellen
sind durch Intercalationsscheiben verbunden. Diese heften die Zellen
aneinander und übernehmen gegenüber den Aktinfilamenden die Funktion
der Z-Scheiben; ausserdem enthalten sie Gap Junctions über die sich
das Aktionspotential von einer Zelle in die nächste ausbreiten kann.
Bei der glattten Muskulatur fehlt das geordnete Muster der Skelett-
und Herzmuskeln. Die Filamende bilden einen locker angeordneten
kontraktilen Apparat aus und sind über scheibenartige Verbindungen
benachbarter Zellen miteinander verbunden.
Vor allem in den glatten Muskeln findet man eine Deaktivierung der
Myosins durch eine Dephosphorylierung.
|





