Unterabschnitte
Membranen
Alle Membranen der Zelle basieren auf einer Lipiddoppelschicht. Die
Lipide der Zellmembran sind allesamt amphipathisch, d.h. sie weisen
ein hydrophiles und ein hydrophobes Ende auf.
Der normale Aufbau der Phospholipide ist der aus einem polaren Kopf
aus z.B. Cholin - Phosphat und Glycerol mit zwei hydrophoben
schwänzen, von denen zumindest einer mindetstens eine cis-Binung
aufweist und somit ungesättigt ist. Die andere Fettsäure ist meistens
gesättigt. Die Fettsäuren enthalten meist zwischen 14 und 24 C-Atomen
und bestimmen durch ihre Eigenschaften die Fluidität der Membran.
Um eine solche Membran künstlich herzustellen ist man zwei
unterschiedliche Wege gegangen. Der eine erzeugt die sogenannten
Liposomen, eine Membrankugel, die andere spannt eine Membran über der
Öffnung zwischen zwei wässrigen Lösungen, eine sogenannte black
membrane. In solchen Membranen kann man die Bewegung eines
spin-markierten Lipids mit der Elektronen-Spin-Resonanz-Spektroskopie
verfolgen.
Während innerhalb einer Lipidschicht eine rege Bewegung herrscht,
findet ein Wechsel von einer Seite der Lipidschicht zur anderen Seite
nur sehr selten statt (Flip-Flop).
Eine Membran lässt sich durch ihren Phasenübergang bei hohen oder
niedigen Temperaturen in einen Gel- oder Kristallzustand
charakterisieren.
Kurze Kohlenstoffketten führen dazu, dass die Membran auch bei
niedrigen Teperaturen noch flüssig bleibt.
Neben Cholesterol enthalten die meisten Membranen der Eukaryonten auch
eine Mischung unterschiedlicher Phospholipide, da bestimmte Proteine,
die sich in die Membran einlagern für ihre Funktion ein bestimmtes
Phospholipid benötigen. Des weiteren sind die Phospholipide
assymmetrisch angeordnet; bestimmte Phospholipide findet man nur
intra- oder extrazellulär. Dies ist auch wichitig, da diese
Ungleichverteilung ein wichtiges Signal für die Aktiviung von
Proteinen auf nur einer Seite der Membran ist.
Die Eigenschaften der Membran werden durch andere Moleküle
modifiziert. Durch die Einlagerung von Cholesterol z.B. wirkt die
Membran mehr als eine Permeabilitätsbarriere und senkt die ,,
Flüssigkeit`` einer Membran.
Lipide, die einen Zucker gebunden haben werden als Glykolipide
bezeichnet. Man findet diese nur an der Aussenmembran, wo sie
Aggregate bilden und sehr wahrscheinlich auch eine Rolle bei der
Interaktion der Zelle mit ihrer Umgebund spielen.
Die Ganglioside enthalten Oligosaccharide an ihrer Oberfläche und sind
vor allem an Neuronen zu finden.
Die genaue Funktion der Glycoproteine ist ungewiss; jedoch nimmt man
an, dass ihre negative Ladung bei den Nerven die Extrazelluläre
Calciumkonzentration erhöht und dass sie bei Prozessen der
Zellerkennung eine wichtige Rolle spielen.
Membranproteine
Neben den Lipiden bilden die in der Membran eingelagerten Proteine den
Hauptanteil der Membran.
Die Proteine können auf unterschiedliche Weisen an die Membran
gebunden sein. Zum einen haben einige Proteine hydrophobe Regionen und
verhalten sich deshalb ähnliche alophatisch wie die Lipide. Andere
Proteine sind kovalent an eine Fettsäure gebunenden und so in der
Membran verankert. Eine Gruppe extrazellulär befestigter Proteine
werden im ER an einerm Glycosyl-Phosphatidylinositol (GPI) befestigt
und darüber in der Membran verankert.
Man unterscheidet die peripheren Membranproteine, die in der Membran
verankert sind und sich leicht von dieser Lösen lassen von den
intregralen Proteinen, die sich ohne die Membran zu zerstören nicht
aus ihr herauslösen lassen.
Die integralen Membranproteine werden wiederum je nachdem wie oft sie
die Membran durchqueren (d.h. wie viele Transmembrandomänen sie
besitzen) in single-pass und multi-pass-Transmembranproteine
unterteilt.
Man nimmt an, dass die allermeisten Proteine die Membran in Form einer
 -Helix durchspannen, da die hydrophoben Bereiche so die
meisten Wasserstoffbrücken ausbilden können.
Da bei einem teilweisen Durchdringen der Membran oder einem Knick
Wasserstoffbrücken verloren gingen, ist diese Form energetische
unüblich und kommt praktisch nicht vor. -Helix durchspannen, da die hydrophoben Bereiche so die
meisten Wasserstoffbrücken ausbilden können.
Da bei einem teilweisen Durchdringen der Membran oder einem Knick
Wasserstoffbrücken verloren gingen, ist diese Form energetische
unüblich und kommt praktisch nicht vor.
Die Extrazelluläre Seite der Proteine ist zumeist glycosyliert und des
bilden sich dort Disulfidbrücken aus, die im Intrazellularraum durch
die dort herrschenden reduzierenden Bedingungen gelöst werden.
Die Proteine der Membran können sich zum einen um eine senkrecht zur
Membran verlaufende Achse drehen (Rotationsdiffusion) und sich
teilweise auch innerhalb der Membran bewegen (laterale Diffusion).
Erste Beweise für die laterlale Diffusion fand man beim Verschmelzen
von Maus- und Säugerzellen. Die Proteine kann man durch Antikörper
nachweisen und fand so heraus, dass nach einer anfänglichen Trennung
eine zunehmende Durchmischung der Membranproteine stattfand.
Dabei konnte man auch das sogenannte Patching, d.h. die
Zusammenlagerung von ,,Flecken`` von Proteinen, wenn ein
Antikörper an ein bestimmtes Protein bindet, die sich nach einiger
Zeit zu einer Kappe vereinigen (capping).
Um die Membranbewegung zu quantifizieren benutzt man eine Technik, die
flourescence recovery after photobleaching FRAP genannt wird. Hierzu
markiert man die Membran mit einem floureszierenden, monovalenten
Antikörper und bleicht diesen an einer Stelle aus. Nach einer
bestimmten Zeit misst man die Floureszenz und kann durch den Augleich
des Ausbleichens die Membrandiffusion quantifizieren.
Die Wandung der Proteine wird durch Tight junctions behindert und auf
bislang unbekannte Art ist es der Zelle ausserdem möglich, die
Diffusion von Molekülen auf bestimmte Bereiche zu beschränken.
Mit Detergentien wie Triton X-100 oder SDS kann man die Moleküle aus
der Membran herauslösen; wobei sie im Falle von SDS auch denaturiert
werden.
Wenn man Erythrocyten in eine niedrig konzentrierte Salzlösung gibt,
kann man sie zum Platzen bringen. Danach lagern sich die Membranen
wieder zusammen und man hat eine leere Membran, die ein sehr
geeignetes Untersuchungsobjekt darstellt, vor allem, da man auch
Vesikel herstellen kann, bei denen die Innenseite der Membran nach
aussen zeigt.
Bei einer Gelelektrophorese der Proteine der Erythrocytenmembran kann
man drei Proteine isolieren, die gemeinsam 60% der Membranprotein
ausmachen.
Diese Proteine dienen - zusammen mit einigen anderen leicht
isolierbaren Proteinen - als Beispiel für die Verknüpfung von Proteinen
mit der Membran:
Spectrin macht 25% der Membranproteinmasse aus. Es ist ein
stäbchenförmiges Protein von 100 nm länge und bildet einen
Hauptbestandteil des Cytoskeletts der Zelle. Es ist ein Heterodimer
aus zwei ähnlich aufgebauten Untereinheiten, die an ihrem Schwanzende
mit Aktin und anderen Elementen des Cytoskeletts verbunden sind.
Das Ankyrin verbindet die Membran mit dem Spectrin, indem es eine
Verknüpfung der Bande-3-Moleküle mit dem Spectrin schafft.
Das Glycophorin ist ein single-pass-Glycoprotein, das eines der
häufigsten Moleküle der Erythroctenmembran ist, das auch nur dort
vorkommt und dessen Bedeutung absolut unklar ist.
Dieses Protein ist ein Transmembranmolekül mit bis zu 14 TMD. Es
arbeitet als Anionentransportmolekül, das HCO3- im Austausch
gegen Cl- durch die Membran transportiert.
Bakteriorhodopsion ist ein Transmembranmolekül, das mit einem
Chromatophor gekoppelt ist und durch Lichteinstrahlung seine
Konformation so ändert, dass es einen Protonengradienten aufbaut, der
dann zum Erzeugen von ATP genutzt wird.
Das Protein besitzt sieben  -helicale TMD und man vermutet,
dass der Protonentransport durch Abgabe eines H+ von einer
Asparaginsäure gestartet wird. -helicale TMD und man vermutet,
dass der Protonentransport durch Abgabe eines H+ von einer
Asparaginsäure gestartet wird.
Die Porine sind ein gut untersuchtes Beispiel, bei dem die
Transmembransegmente von einem Zylinder, bestehend aus einem
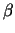 -Faltblatt gebildet werden. -Faltblatt gebildet werden.
Es ist ein Bestandteil der äusseren Bakterienmembran und erlaubt
bestimmten Substanzen, diese Membran zu durchdringen.
Modifikationen der Membranoberfläche
Die Zelle ist von einem als Glykocalyx bezeichneten Kohenhydrathülle
bedeckt.
Proteoglykane sind Polysaccharidketten, die mit einem Proteinkern
verbunden sind und einen wichtigen Bestandteil der extracellulären
Matrix bilden.
Bei den intragralen Membranproteoglycanen ist der Proteinkern mit der
Membran durch einen Glykosyl-Phosphatidylinositol-Anker verbunden oder
erstreckt sich über die Membran.
Neben ihrer Funktion als mechanischer Schutz spielt die Glykocalyx
eine wichtige Rolle bei der Zellerkennung. Denn dadurch, dass die
Zucker untereinander ganz unterschiedliche Bindungen aufbauen können,
reichen schon wenige Zucker um eine nahezu unbegrenzte Anzahl von
Signalen zu kodieren.
Ein Beispiel einer solchen Zellerkennung bietet z.B. die Zellerkennung
an einem Entzüngungsherd. In einem solchen Fall senden die entzündeten
Zellen ein Signal aus, dass die Endothelzellen im Umfeld dazu
veranlasst, ein bestimmtes Glykoprotein, das P-Selektin zu
exprimieren. Dieses hat an seinem Ende eine Lectin-Domäne, die
selektiv an bestimmte Oligosaccharide, die von Glycoproteinen und
-lipiden an der Oberfläche von neutrophilen Granulocyten angeboten
werden zu binden, dass diese sich zwar gebunden werden, aber auch noch
entgegen dem Blutstrom ,,rollen`` können, ohne dass sie so
fest gebunden werden, wie dies z.B. bei den Integrinen der Fall ist.
|





