Singalübertragung
Grundlage der Signalübertragung ist die Diffusion.
Ein Molekül, das von der Zelle sezerniert wurde, kann parakrin (das
Signal diffundiert nicht weit weg und wirkt lokal), synaptisch (das
Nervenende sezerniert die Substanz an einer entfernten Synapse) oder
endorkrin (Hormone werden über den Blutkreislauf verteilt) wirken.
Senet die Zelle ihr Signal an Zellen vom gleichen Typ (etwa in einem
Verband), dann spricht man von einer autokrinen
Signalübertragung. Diese Übertragung kann sich selbst verstärken,
indem die umgebenen Zellen in einem Verband auf das Signal hin den
gleichen Transmitter ausschütten.
Die autokrine Signalübertragung findet man vor allem bei Wachstums-
und Differenzierungsprozessen, sowie z.B. bei Gewebsschädigung durch
die Eicosanoide.
Wenn Zellen miteinander über Gap Junctions verbunden sind, kann der
Austausch von intrazellulären Mediatoren wie Calcium, cAMP und anderen
kleinen Molekülen auch direkt geschehen.
Das gleiche Signalmolekül (z.B. ACh) kann bei unterschiedlichen Zellen
eine unterschiedliche Wirkung haben.
Wird die Syntheserate eines Moleküls positiv beeinflusst, so
entspricht die Zeit, nach der das System die Hälfte des neuen
Gleichgewichts erreicht hat, der Halbwertszeit des Stoffes wenn die
Synthese schlagartig stoppen würde.
Signalüberträger
Stickstoffmonoxid (NO) wird von der NO-Synthase durch Desaminierung
von Arginin gebildet. Auf Grund seiner Grösse kann das Molekül in
benachbarte Zellen diffundieren und dort seine Wirkung entfalten.
NO reguliert häufig die Guanylatcyclase, die dadurch zur Synthese von
cGMP angeregt wird.
Die Steroide, Thyreoidhormone, Retinoide und das Vitamin D sind kleine
hydrophobe Moleküle.
Durch ihren hydrophoben Charakter haben sie im Blut eine wesentlich
längere Verweildauer als die hydrophilen Transmitter.
Die Steroidhormone werden alle aus Cholesterol gebildet. Sie
beeinflussen den Stoffwechsel und die Ausprägung der
Geschlechtsmerkmale.
Vitamin D wird in der Haut durch das Sonnenlicht gebildet und
reguliert den Calciumhaushalt der Zelle.
Die Thyreoidhormone werden aus Tyrosin hergestellt und erhöhen den
Stoffwechsel.
Die Retinoide spielen ihre Rolle bei entwicklungsspezifischen
Prozessen.
Diese Hormone führen in der Primärantwort zu einer vermehrten
Transkription bestimmter Gene, die in eine verzögerten Sekundärantwort
wiederum andere Gene aktivieren und so eine langanhaltende Wirkung auf
die Zelle haben. Eine Zelle kann demnach auf eines der Hormone auf
mehreren Ebenen unabhängig reagieren (Rezeptor- und
Transkriptionsebene).
Rezeptoren
Die Rezeptoren lassen sich in drei Familien unterteilen:
![\begin{entry}
\item [Ionenkanal-gekoppelte Rezeptoren] \mbox{} \\
Dieser Über...
...Phosphorylierung), wenn ein
Ligand im extrazellulären Raum bindet.
\end{entry}](img11.png)
Sowohl bei den G-Proteine gekoppelten als auch bei den katalytischen
Rezeptoren erfolgt die Wirkung dadurch, dass eine Phosphatgruppe an
ein Enzym angehängt wird (einmal durch direkte Phosphorylierung und
einmal durch Anhängen des Phosphats an das GDP).
Durch die Serin/Threonin-Kinasen und die Tyrosinkinasen wird dann auf
der ersten Ebene eine Phosphorylierungskaskade gestartet.
G-Protein-gekoppelte Rezeptoren
Man unterscheidet bei den G-Protein gekoppelten Rezeptoren die
stimulatorischen G-Proteine Gs, die ein Enzym stimulieren von den
inhibitorischen Gi, die ein Enzym inhibieren.
Ein trimäres G-Protein setzt sich aus den Einheiten  , , 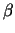 und
und 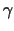 zusammen. zusammen.
Bei den stimulatorischen G-Proteinen ist die  -Einheit im
inaktiven Zustand an GDP gekoppelt. Wird der Rezeptor aktiviert,
tauscht es dieses gegen ein GTP aus. Dadurch löst sich die -Einheit im
inaktiven Zustand an GDP gekoppelt. Wird der Rezeptor aktiviert,
tauscht es dieses gegen ein GTP aus. Dadurch löst sich die
 -Einheit, diffundiert in der Membran und aktiviert die
Adenylatzyklase. Diese Bindung stimuliert die GTPase-Aktivität der -Einheit, diffundiert in der Membran und aktiviert die
Adenylatzyklase. Diese Bindung stimuliert die GTPase-Aktivität der
 -Einheit, hydrolysier das GTP wodurch sich die -Einheit, hydrolysier das GTP wodurch sich die
 -Einheit löst und die Adenylatzyklase inaktiviert wird. -Einheit löst und die Adenylatzyklase inaktiviert wird.
Bei Cholera findet durch die Einwirkung eines Toxins an der
 -Einheit eine Modifikation statt, so dass diese sich nicht
mehr deaktivieren kann und die Adenylatzyklase permanent aktiviert
bleibt. Bei den Epithelzellen des Verdauungstraktes führt das zu einem
Natrium- und Wasserausstrom und somit zu Durchfall. -Einheit eine Modifikation statt, so dass diese sich nicht
mehr deaktivieren kann und die Adenylatzyklase permanent aktiviert
bleibt. Bei den Epithelzellen des Verdauungstraktes führt das zu einem
Natrium- und Wasserausstrom und somit zu Durchfall.
Die inhibitorischen G-Proteine unterscheiden sich von den
stimulierenden durch eine andere  -Untereinheit. Die Bindung
des Liganden hat dann mehrere Effekte: Zum einen wird die -Untereinheit. Die Bindung
des Liganden hat dann mehrere Effekte: Zum einen wird die
 -Einheit abgelöst und kann die Adenylatzyklase hemmen und für
einen Kaliumeintrom sorgen; zum anderen wird der restliche Komplex
frei und kann nun die -Einheit abgelöst und kann die Adenylatzyklase hemmen und für
einen Kaliumeintrom sorgen; zum anderen wird der restliche Komplex
frei und kann nun die  -Einheit eines stimulatorischen
G-Proteins binden. -Einheit eines stimulatorischen
G-Proteins binden.
Bei einigen trimären G-Proteinen findet man auch eine direkte
Beeinflussung eines Ionenkanals durch die  -Untereinheit. -Untereinheit.
Müssen mehrere Untereinheiten eines Protiens aktiviert werden oder
sind für die Aktivierung eines Proteins mehrere second messenger
notwendig, dann kommt es häufig zu einer Alles-oder-Nichts-Antwort.
Ein weiteres Verschärfen der Antwort ergibt sich dann, wenn der second
messenger ein Enzym aktiviert und ein anderes mit dem gegenteiligen
Effekt hemmt. Ein extremes Alles-oder-Nichts-Signal wird dann
erreicht, wenn es zu einem positiven Feedback kommt, wie dies etwas
bei den Natriumkanälen während der Depolarisation der Fall ist.
cAMP wird durch die Adenylatcyclase aus ATP hergestellt und über die
cAMP-Phosphodiesterase zu 5'-AMP abgebaut.
Meist regen die Rezeptoren die Adenylatzyklase an und erhöhen so den
cAMP-Spiegel.
cAMP entfaltete seine Wirkung, indem es die cAMP-abhängige
Proteinkinase A (PKA) beeinflusst.
Diese modifiziert die Serin- oder Threoninreste eines Proteins, wenn
diesen zwei basische Aminosäuren vorangestellt sind. Im inaktiven
Zustand ist die PKA aus zwei regulatorischen und zwei katalytischen
Untereinheiten aufgebaut. Durch die Bindung von cAMP an die
regulatorischen Untereinheiten lösen sich diese und aktivieren dadurch
die katalytischen Untereinheiten.
In Skelettmuskelzellen wird auf diese Weise der Glykogenabbau
gesteuert.
Wenn cAMP auf die Transkription einwirkt, dann geht dies immer über
eine Phosphorylierung des CRE-Bindeproteins, die die
transkriptionsfördernde Aktivität dieses Proteins erhöht. Das Protein
bindet dann an eine spezifisches (CRE-cAMP response element) Motiv auf
der DNA und verändert so die Transkription.
Die Deaktivierung der Phosphorylierung erfolgt durch die
Serin/Threonin-Proteinphosphatase. Der Phosphorylierungszustand des
Proteins hängt von dem Gleichgewicht zwischen diesen Enzymen und der
PKA ab.
Durch den hohen Calciumgradien zwischen intra- und extrazellulär und
zwischen intrazelllär und dem ER führt ein Öffnen der Ca-Kanäle zu
einem starken Signal.
Bei dieser Kaskade wirkt nicht cAMP, sondern IP3 als second
messenger. Hier aktiviert ein G-Protein die Phospholipase C. Diese
spaltet das Phosphatidylinositol-Bisphosphat (PIP2) in
Inositoltriphosphat (IP3) und Diacylglycerol.
Das IP3 kann direkt auf die IP3-abhängigen Calciumkanäle einwirken und
diese Öffnen. Diese Kanäle besitzen ein postives Feedback, indem sie
durch Calcium weiter aktiviert werden und so in letzter Konsequenz zu
einer Alles-oder-nichts-Reaktion führen.
Neben der Wirkung des Calciums mit dem Diacylglycerol zusammen (siehe
unten) wirkt es vor allem auf calciumbindende Proteine wie das
Calmodulin ein. Calmodulin hat vier hochaffine Bindungsstellen für
Calcium und ändert durch dessen Bindung seine Konformation. Die
Aktivierung des Calmodulins erfolgt analog zu der Aktivierung der PKA
durch cAMP. Das Calmodulin selbst hat keine enzymatische Aktivität;
allerdings moduliert es die Wirkung anderer Proteine indem es an diese
bindet oder sogar einen Teil eines Enyzmkomplexes bildet.
Einer der Haupteffekte des Calmodulins besteht darin, dass es die
Ca2+/Calmodulin-anhängigen Proteinkinasen (CaM-Kinasen)
moduliert. Diese phosphorylieren Serin und Threoninreste und haben vor
allem auch einen Mechanismus, der zur Autophosphorylierung führt, so
dass sich das Protein selbst phosphoryliert und damit auf längere Zeit
hin aktiv bleibt.
Das Diacylglycerol hat zwei Wirkungen. Zum einen kann es zu
Archidonsäure abgebaut werden, welche dann selst als Botenstoff dient
oder die Synthese von Eicosanoiden reguliert.
Aug einem anderen Weg aktiviert die Proteinkinase C (PKC). Die PKC
wird sehr wahrscheinlich durch den von IP3 initiierten Calciumeinstrom
dazu gebracht, sich an der Innenseite der Membran anzulagern. Dort
wird sie dann von Diacylglycerol und Calcium aktiviert. Diese kann
dann durch Phosphorylierung andere Proteine und auch den
Transkriptionsapparat beeinflussen. Die Diacylglycerolkonzentration
wird durch eine von der Phospholipase durchgeführte Spaltung der
Phospholipide der Membran erhöht. So sind auch längere Effekte
möglich.
Einige der cAMP auf- oder abbauenden Enzyme werden von Calcium oder
Calmodulin reguliert; auf der anderen Seite kann die PKA die Aktivität
von Calciumpumpen und Kanälen durch Phosphorylierung ändern.
Deutlich zeigt sich die Interaktion der beiden Systeme bein
Glucoseabbau im Skelettmuskel: Die Phosphorylase-Kinase, ein Enzym
phosphoryliert ein anderes Enzym, was dann zum Glucoseabbau führt.
Die Kinase besteht aus vier Untereinheiten, von denen eine die
katalytische Aktivität trägt und eine Calmodulin ist. Die beiden
anderen werden cAMP-reguliert von der PKA phosphoryliert.
Die Bereitstellung von Glucose wird auf unterschiedlichen Wegen
eingeleitet. Zum einen kann der Calciumeinstrom bei der Kontraktion
die Bereitstellung der Glucose veranlassen. Andererseits kann aber
auch durch Noradrenalin übder den cAMP-Weg die Aktivität gesteigert
werden.
Katalytische Rezeptoren
Man kennt heute fünf Gruppen von Rezeptoren, an die ein Enzym
gekoppelt ist:
- Rezeptor-Guanylatcyklasen stellen cGMP her
- Rezeptor-Tyrosinkinasen phosphorylieren Tyrosinreste
- Tyrosinkinase-assoziierte Rezeptoren sind mit Proteinen
assoziiert, die Tyrosinkinaseaktivität haben.
- Rezeptor-Tyrosinphophatasen entfernen das Phosphat von
Signalproteinen
- Rezeptor-Serin/Threoninkinasen phosphorylieren spezifisch Serin-
oder Threoninreste an einigen Proteinen.
Diese Familie umfasst nur wenige Rezeptoren und wirkt, indem das
gebildete cGMP eine cGMP-abhängige Proteinkinase aktiviert, welche
wiederum spezifische Proteine phosphoryliert.
Diese sehr grosse Familie umfasst viele der Rezeptoren für
Wachstumsfaktoren wie den EGF, den NGF, den PDGF oder den IGF-1. Die
Rezeptoren durchspannen die Membran einmal.
Das Binden eines Liganden führt zur Bildung eines Dimers aus zwei
Rezeptoren, so dass sich diese gegenseitig an mehreren Tyrosinresten
gegenseitig phosphorylisieren. Die autophosphorylierte Stelle dient
dann als Binungsstelle für andere hochaffine Signalmoleküle innerhalb
der Zelle.
Die bindenden Proteine sind z.B. ein GTPase aktivierendes Protein,
die Phospholipase C 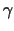 oder die
Nicht-Rezeptorprotein-Tyrosinkinasen. Diese Proteine wirken zwar
unterschiedlich, weisen aber alle eine Scr-Homologieregion-2 und -3
auf. Diese SH2-Domänen erkennen phophorylisierte Proteine und dienen
vermutlich dazu, an die phosphorylierte Stelle zu binden. oder die
Nicht-Rezeptorprotein-Tyrosinkinasen. Diese Proteine wirken zwar
unterschiedlich, weisen aber alle eine Scr-Homologieregion-2 und -3
auf. Diese SH2-Domänen erkennen phophorylisierte Proteine und dienen
vermutlich dazu, an die phosphorylierte Stelle zu binden.
An der cytoplasmatischen Seite der Membran liegen die Ras-Protein. Bei
diesen handelt es sich um monomere GTPasen. Sie unterstützen die
Wirkung der Rezeptor-Tyrosinkinasen. Da die Ras-Proteine GTP sehr
langsam hydrolysieren, bleiben sie einmal aktiviert praktisch
dauerhaft aktiv. Wenn allerdings die GTPase-aktivierenden Proteine
aktiv sind, können sie die Hydrolysegeschwindigkeit der Ras-Proteine
deutlich erhöhen. Dem entgegen wirken die
Guaninnucleotid-freisetzenden Protein (GNRPs), die GDP gegen GTP
tausche und Ras so in seiner aktiven Form halten.
Die Rezeptor-Tyrosinkinasen können die Aktivität von Ras durch
Phosphoryliern dieser beiden Proteine steuern. Ein gut untersuchtes
Beispiel für eine solche Interaktion mit Ras ist die Entwicklung der
Ommatidien bei Drosophila:
Bei Drosophila baut sich ein Ommatidium aus insgesamt 8
photorezeptiven Zellen auf. Bei der Mutante sevenless (sev) fehlt die
Zelle 7, die zur Wahrnehmung von UV-Licht benötigt wird. Das für diese
Mutationen verantworliche Gen war eine Rezeptortyrosinkinase. Für dessen
Ligand codiert das Gen boss (bride of sevenless). Dieses wird als
Transmembranmolekül auf der Oberfläche der zentralen Rezeptorzelle R8
exprimiert. Durch den Kontakt zwischen Sev und Boss wird das
Sev-Protein aktiviert und führt über die Phosphorylierung mehrere
Proteine zu einer Aktivierung von Ras, welches danneine
Phosphorylierungskaskade in Gang setzt.
Durch diese Kaskade wird das sehr kurzlebige Signal in ein zum
Wachstum anhaltendes langfristiges Signal umgewandelt. Hierbei spielen
die sogenannten mitogenaktivierten Protein - Kinasen (MAP-Kinasen)
eine entscheidende Rolle: Damit sie vollständig aktiv werden müssen
sie an einem Threonin- und einem Tyrosin-Rest phosphoryliert
werden. Die Phosphorylierung beider Reste wird durch die
MAP-Kinase-Kinase katalysiert. Die MAP-Kinase wird durch die
sogenannte MAP-Kinase-Kinase aktiviert. Diese wiederun wird von der
MAP-Kinase-Kinase-Kinase aktivier, indem diese Serin/Threoninreste
phosphoryliert. Die MAP-Kinase-Kinase-Kinase wird sehr wahrscheinlich
von einem Tyrosinkinase-Rezeptor über das Ras-Protein oder über ein
trimäres G-Protein aktiviert.
Durch die Aktivität der MAP-Kinase werden bestimmte genregulatorische
Protein phosphoryliert, welche dann die Transkription beeinflussen.
Diese Beeinflussung kann durch die Wanderung der Kinase in den
Zellkern, die Wanderung eines Faktors oder die Freisetzung eines
Hemmstoffs umgesetzt werden.
Diese Rezeptoren arbeiten ähnlich wie die Rezeptor-Tyrosinkinasen, nur
dass sie mit ihrer Kinase-Domäne über nicht-kovaltente
Wechselwirkungen verbunden sind.
Auch bei diesen Rezeptoren wird die Aktivierung sehr wahrscheinlich
durch eine Dimerisierung des Rezeptors eingeleitet. Die Kinasen
befinden sich an der Innenseite der Plasmamembran und besitzen alle
SH2 oder SH3-Domänen. Diese Kinasen können zumeist sowohl mit
Rezeptoren ohne eigene Kinaseaktivitiät als auch mit Rezeptoren, die
selbst Tyrosinkinaseaktivität besitzen interagieren.
Die Protein-Tyrosin-Phosphatasen entfernen Phosphatgruppen von
spezifischen Phosphoryrosinen an bestimmten Proteinen. Sie limitieren
das Ausmass der phosphorylierten Tryosinreste in der ruhenden Zelle.
Ein wichtiges Beispiel für die Wirkung dieser Gruppe von Phosphatasen
ist das CD45-Protein auf der Oberfläche von weissen
Blutkörperchen. Durch eine Quervernetzung des Proteins über Antikörper
wird die Phosphatase-Domäne aktiviert und diese bewirkt durch
Dephosphorylierung von Phosphatasen, dass diese aktiviert werden
können.
Bei den transformierenden Wachstumsfaktoren (TGF) hat man erstmals einen
Rezeptor mit Serin-/Threonin-Proteinkinasen-Aktivität gefunden. Er hat
eine Membrandurchspannende Domäne; über die Signaltransduktion ist
wenig bekannt.
Im Prinzip kann eine Überexpression von jedem der Signalkaskade zur
Wachstumssteurung Krebs zur Folge haben, da in diesem Fall das
Wachstum unabhängig von äusseren Einflüssen gefördert wird.
Auch wenn durch einen Virus etwas das virale v-src-Oncogen in die
Zelle eingebracht wird - oder wenn eine ras-Mutation eingebracht wird,
die nicht inaktiviert werden kann - dann führt das zu Krebs.
Die Krebs verursachenden Gene werden Oncogene genannt.
Adaptation auf Zellebene
Unter Adaptation versteht man einen desensiblisierenden Effekt, der
dazu führt, dass die Antwort auf ein signal mit der Zeit schwächer
wird.
Ein Weg der langsamen Reaktion besteht darin, dass ein grosser Teil
der Rezeptoren, die mit dem Substrat in die Zelle aufgenommen wurden,
in den Lysosomen mit verdaut wird, somit die Rezeptordichte fällt und
die Zelle desensibilisiert.
Der schnellere Weg führt über eine ligandengesteuerte Phosphorylierung
des Rezeptors. Bei einer homologen Desensibilisierung mach der Ligand
die Zelle nur für sich selbst unempfindlich.
Diese Adaptationsmechanismen spielen bei Suchterscheinungen wie der
Opiumsucht eine entscheidende Rolle. Morphin verringert über eine
Phosphorylierung durch die cAMP-abhängige PKA die Leitfähigkeit der
Ionenkanäle und damit auch die Geschwindigkeit der Reizleitung. Bei
einer Adaptation kommt es zu einer Erhöhung der PKA-Expression und so
zu einem Ausgleich der Leitfähigkeit. Nach dem Absetzen der Droge ist
dieses Enzym dann überexprimiert und führt zu den benkannte
Entzugssymptomen.
Bei Bakterien verändert die chemische Adaptation an einen Lock- oder
Schreckstoff die Häufigkeit von Taumelbewegungen, die einen zufälligen
Richtungswechsel herbeiführen. Eine Konzentrationänderung erhöht die
Anzahl der Taumelbewegungen zunächst; mit der Zeit nehmen diese aber
ab. Diese Adaptation kann nach einiger Zeit durch ein erneutes Erhöhen
der Konzentration ausgeglichen werden.
Die Adaptation erfolg durch eine Methylierung.
Unterabschnitte
|





