Unterabschnitte
Mitose und Zellteilung
Zellzyklus
Der Zellzyklus lässt sich zunächst in eine Phase, in der keine
Teilung, sondern nur die DNA repliziert wird - die Interphase - und
eine Phase, in der sich die Zelle teil - die M-Phase (oder
Mitosephase) unterteilen. Nach der Teilung sind zwei Zellen
entstanden. Diesen Zustand nennt man Cytokinese.
Die Zeit, in der in der Interphase die DNA repliziert wird, wird als
S-Phase bezeichnet. Der Zeitraum von einer Mitose bis zum Beginn der
nächsten DNA-Replikation vergeht einige Zeit. Diese Zeit wird als
G1-Phase bezeichnet. Die Zeit zwischen Ende der Replikation und dem
Beginn der nächsten Mitose wird als G2-Phase Bezeichnet.
Dabei steht S für Synthese und G für Gap, also Lücke.
Der normaler Zellzyklus verläuft also wir folgt:
- G1-Phase (6-12 h)
- S-Phase (6-8 h)
- G2-Phase (3-4 h)
- M-Phase (1 h)
- Neubeginn bei G1-Phase
Dieser Zyklus kann bestimmte Modifikationen erfahren. Zellen in der
G1-Phase können in einer G0-Phase übergehen, in der sie dann ein
Ruhestadium erreichen und sich nicht weiter teilen.
In dem embryonalen Zellzyklus hingegen sind die G1- und die G2-Phase
drastisch verkürzt und es findet praktisch kein Grössenwachstum
statt.
Man kann mit einem floureszenzaktivierten Zellsorters die Zellen nach
ihrem DNA-Gehalt aufteilen und somit die Zellen nach ihren Phasen
auftrennen.
Im wesentlichen erfolgt eine Phase des Zellzyklus automatisch auf die
nächste und führt so zu einem automatischen Ablauf des Zyklus. Nur an
den wichtigen Punkten, dem Beginn der Replikation, dem Beginn der
Mitose und dem Ende der M-Phase besteht eine explizite Kontrolle.
Die Kontolle am G2-Restriktionspunkt, also dem Übergang von G2- zur
M-Phase wird wird von zwei Enzymfamilien kontrolliert: Den
Cyklin-abhängigen Proteinkinasen (Cdk) und den Cyklinen.
Die Cdk sind eine Familie von Serin- und Threoninkinasen, die durch
Bindung der Cykline aktiviert werden. Man unterscheidet zwei
Hauptklassen von Cyklinen: Die mitotischen Cykline und die
G1-Phase-Cykline.
Die mitotischen Cykline binden an die Cdk und bilden so den
M-Phase-Förderfaktor (MPF). Dieser wird durch andere Enzyme aktiviert
und steigt zu Beginn der Mitose durch ein postives Feedback rapide
an. Am Ende der Mitose fällt die Aktivität ebenso rapide wieder ab.
Die Vorgänge am G1-Restriktionspunkt sind weniger gut untersucht als
die am G2-Restriktionspunkt, aber man geht davon aus, dass sie sich
ähneln.
Der Auf- und Abbau des Cyklins ist also das entscheidende, den
Zellzyklus vorantreibende Element.
Die Eizelle bei Xenopus enthält die 100.000fache Menge an Cytoplasma
gegenüber einer normalen Körperzelle, jedoch nur einen Zellkern. Die
Meiose ist von Hormonen kontrolliert und zweifach am
G2-Restiktionspunkt gestoppt.
Nach der Befruchtung folgt dann eine sehr schnelle Furchungsteilung,
bei der sich Mitose und Replikation ohne weiteres Wachstum
abwechsel. Die Interphase und die M-Phase dauern während der ersten 11
Furchungsteilungen jeweils 15 Minuten; die G-Phasen fehlen praktisch
vollständig.
Wenn man das Cytoplasma einer M-Phasen-Zelle in eine unbefruchtete
Zelle in der G2-Phase injiziert, geht diese in die M-Phase über. Den
so entdeckten Kontrollfaktor des Cytoplasmas nennt man MPF (maturation
promoting factor oder M-Phase-Förderfaktor).
Ein gleichwertiges Experiment hat man bei Säugern durch das
Verschmelzen zweier Zellen (eine in der M- eine in der Interphase)
gemacht. Auch hier geht die Interphasenzelle direkt in die Mitose
über.
Die Zellteilung eines Seeigeleis geht auch nachdem der Zellkern
entfernt wurde weiter. Die Kontrolle erfolgt also durch das
Cytoplasma. Das dafür verantworliche Cyclin wurde durch radiaktive
Markierung der Proteinbiosynthese entdeckt. Man fand dabei eine Klasse
von Proteinen, deren Expression zyklisch mit de Mitose schwankte. Das
Cyclin wird am Übergang zwischen Meta- und Anaphase durch Proteolyse
schnell zerstört. Dies signalisiert den Austritt aus der Mitose.
Der MPF ist für viele Ereignisse verantwortlich: Das Desaggregieren
des Laminins der Kernhülle, eventuell die Bildung der Chromosomen
durch Phosphorylieren von Histon H1, der Verhalten der MT durch
Phosphorylierung von MAPs und einige andere Prozesse werden von MPF
eingeleitet und gefördert.
In der Embryonalen Zelle läuft der Zyklus streng zeitgesteuert ab. Die
Kontrollmechanismen besitzen keine Rückkoplung zur DNA und leiten die
Mitose selbst dann ein, wenn die Replikation noch nicht zu ihren Ende
gekommen ist.
Es scheint aber bei allen Zellen einen Mechanismus zu geben, der eine
doppelte Replikation der DNA verhindert. Die molekularen Grundlagen
dieses Mechanismuses sind noch nicht bekannt, allerdings kannn man
z.B. auch durch Fusion einer G2-Zelle mit einer Zelle in der S-Phase
die Zelle in G2 nicht mehr zu einer Replikation bringen.
Man nimmt an, dass das Rückgängigmachen dieses Prozesses von einem
cytoplasmatischen Faktor
abhängt, der nur während sich die Kernmembran aufgelöst hat an die DNA
gelangen kann und dann die Doppelreplikationssperre während der
Replikation wieder aufhebt.
Die Das vornehmliche Untersuchungsobjekt für die molekularen
Grundlagen der Zellteilung war die Hefe, da diese sowohl in einem
diploiden, als auch in einem haploiden Zustand vorkommt und man im
letzteren sehr leicht bestimmte Gene ausschalten kann.
Um auch über mehrere Generationen hinweg eine Konstante Grösse der
Zelle zu gewährleisten muss es in der Zellteilung
Grössen-Restriktionspunkte geben, an denen der Zellzyklus erst nach
erreichen einer bestimmten Grösse fortgesetzt wird. Dieser Punkt kann
sowohl in der G1- als auch in der G2-Phase liegen.
Zwei Mutanten von Genen des Zellzyklus sind sehr aufschlussreiche
Untersuchungsobjekte: Den cdc Mutanten fehlt ein Genprodukt zum
Überschreiten eines bestimmten Punktes im Zellzyklus, während den
wee-Mutaten ein Gen fehlt, das normalerweise die Grössenrestriktion
steuert, so dass sich diese Mutaten schon einem sehr kleinen Stadium
teilen.
Bei solchen Mutanten der Spalthefe fand man das Gen cdc2, das einen
Hauptbestandteil des MPF bildet. Wenn das Cyclin an das Cdc2-Protein
bindet, bildet dies den MPF. Dieser ist dann Substrat für zwei
Kinasen, die aktivierende Kinase MO15 und die hemmende Kinase Wee1,
die das Protein an unterschiedlichen Stellen phosphorylieren. Erst
wenn durch die Phosphatase Cdc25 die hemmdende von Wee1 angebrachte
Phosphatgruppe abgespalten wird, bildet sich das aktive MPF, der dann
die Mitose einleitet.
Bei der Spalthefe kontrolliert das Verhältnis von MO15 und Wee1 den
Grössenrestriktionspunkt in G2.
Neben diesem Punkt in G2 ist vor alem der als START bezeichnte
Restriktionpunkt in G1 wichtig, da hier bei den Hefen nicht nur
zwischen einer Pause und dem weiteren Durchlaufen des Zyklus
entschieden wird, sondern auch die Entscheidung fällt, ob ein
Paarungstypwechsel durchgeführt wird oder nicht.
Auch dieser Punkt wird von dem Cdc2-Enzym gesteuert - allerdings
durch Interaktion mit einem anderen Protein, dem G1-Cyklin. Der so
gebildete START-Komplex phosphoryliert andere Substrate als dies bei
dem MPF der Fall ist. In der normalen Hefe gibt es mindestens drei
G1-Cykline, die zumindets teilweise auch funktionell gegeneinander
austauschbar sind; zumindet können einzelne G1-Zykline ohne
Beeintrachtigung des Zellzyklus deletiert werden. Das Zusammenwirken
der drei Cykline führt sehr wahrscheinlich zu einer ähnlichen
positiven Rückkopplung, wie dies bei dem MPF der Fall ist.
Durch einen Mangel im Nahrungsangebot verringert sich die
Konzentration der G1-Cycline und verhindert so den Eintritt in die
S-Phase.
Eine Zelle wird durch Inhibitoren der DNA-Synthese in der S-Phase
festgehalten und kann - durch einen unbekannten Mechanismus - durch
die Gabe von Coffein dazu gebracht werden, noch vor Ende der
Replikation mit einer zerstörerischen Mitose zu beginnen.
Durch DNA-Schäden oder Chromosomen, die nicht in der Mitosespindel
ausgerichtet sind, sendet die Zelle ein Signal, das die Mitose
verzögert.
Bei den Eukaryonten setzt sich der MPF aus dem p34 und den Cyklinen
der Klasse A oder B zusammen. Die letzte Aktivierung des MPF erfolgt
durch eine Autophosphorylierung des Proteins. Zum Ende der Mitose
müssen die Cykline durch Proteasen abgebaut sein.
Die meisten an der Mitose beteiligten Proteine werden - wie auch der
MPF - durch Phosphorylierung aktiviert. Die Phosphorylierung durch
die M-Phasen-Kinase ist für diese Phosphorylierungen verantworlich,
indem sie die Substrate entweder direkt oder über eine Kaskade
phosphoryliert. Zu den Substraten zählen die H1-Histone, Lamine,
Nucleolin, etc.
In vielzelligen Organismen findet man zwar auch den in der Hefe
beschriebenen Kontrollapparat, allerdings gibt es dort mehrere
Varianten des Cdc2 und auch zumindest sechs unterschiedliche Cycline.
Ein Problem der Untersuchung des Zellzyklus an Gewebekulturen ist die
potentielle Unsterblichkeit einer solchen Kultur, die darauf hinweist,
das eine Mutation in der normalen Kontrolle des Zellzyklus vorliegt.
Bei den Gewebekulturen konnte man diese über lange Zeit hinweg nur
dann zur Proliferation bringen, wenn man Serum aus Blutgerinseln
zusetzte. Nach langer Zeit konnte man die dafür verantwortlichen
Wachstumsfaktoren identifizieren.
Die Wachstumsfaktoren können bei einem breiten Spektrum von Zellen
wirken, wie dies bei EGF oder PDGF der Fall ist oder nur ganz
spezifisch an einer Gruppe von Zellen wirken - wie dies z.B. beim
Erythropoietin der Fall ist, das nur an den Vorläufern der roten
Blutkörperchen wirkt. Meisten hängt das Wachstum einer Zelle nicht von
einem einzelnen Faktor, sondern von einer Kombination von Faktoren
ab.
Bei den Säugerzellen werden das Zellwachstum und die Zellgrösse
unabhängig von einander reguliert. Diese Kontrolle kommt durch eine
Kombination von inneren und äusseren Faktoren zustande. So werde
Nervenzellen z.B. um so grösser, desto mehr NGF vorhanden ist.
Eine wichtige Fähigkeit der Säugerzellen besteht darin, in die
G0-Phase überzutreten und so die Teilung zu kontrollierten. So gibt es
Zellen, die sich nie mehr Teilen (Nerven und Muskeln) und solche, die
sich mehrmals am Tag teilen wie die Epithelzellen im Darm.
Das Fehlen von Wachstumsfaktoren an G1-Restriktionspunkt zwingt die
Zelle in die G0-Phase, aus der sie selbst nach nur einem kurzen Entzug
der Wachstumsfaktoren erst nach mehreren Stunden entkommt. Dies ist
dadurch begründet, dass in der G0-Phase viele G1-Cykline und auch
viele der Cdk-Proteine nicht nur inaktiviert, sondern komplett
abgebaut werden.
Das Wachstum der Zellen in einem Gewebe wird sehr wahrscheinlich
dadurch gehemmt, dass die Zellen um Wachstumsfaktoren konkurrieren und
eine Zelle einer anderen die Wachstumsfaktoren durch Binden an die
entsprechenden Rezeptoren entzieht.
Ein weiterer Faktor schien die Verankerungsabhängigkeit zu sein. Die
Zellen teilen sich nur dann, wenn sie beim G1-Restriktionspunkt
verankert sind, d.h. wenn sie zu diesem Zeitpunkt Fokalkontakte
ausgebildet haben.
Bei der Untersuchung von Krebszellen fand man Gene, die die Zelle über
den G1-Restriktionspunkt hinwegführen und Proliferations-Gene genannt
werden sowie Gene, die die Zelle in G1 halten und
anti-Proliferations-Gene genannt werden.
Mutieren diese Gene, führt das zu Krebs - sie werden deshalb auch als
Oncogene bezeichnet. Das Gen in seinem normalen Zustand wird als
Proto-Oncogen bezeichnet. Die anti-Proliferationsgene werden auch als
Tumor-Supressor-Gene bezeichnet. Nur wenn in einer diploiden Zelle
beide Kopien eines Tumor-Supressor-Gens fehlen, kommt es zu einem
Tumor.
Nach dem Binden eines Wachstumsfaktors kommt es zur Aktivität
verschiedner Kinasen, die über eine Kaskade zu einer Aktivierung
unterschiedlicher Gene führen. Diese können in Gene für eine frühe und
eine verzögerte Antwort unterteilt werden.
Beide Gene werden während der G0-Phase nicht transkribiert und erst
nach Zugabe von Wachstumsfaktoren aktiviert. Die Gene der zweiten
Klasse werden auch bei einer weiteren Gabe von Wachstumsfaktoren
beibehalten. Die der ersten Klasse werden nach einer gewissen Zeit der
Gabe von Wachstumsfaktoren wieder deaktiviert.
Zu den schnell aktivierten Proteinen gehören myc-, fos- und
jun-Protooncogene, während Cykline und Cdk erst nach einer längeren
Verzögerung induziert werden, da sie teilweise zu ihrer Aktivierung
frühe Gene wir myc benötigen.
Das Retinoblastom-Gen ist ein Tumorsupressorgen, das bei einer
Inaktivierung von beiden Allelen zu Krebs führt. Das Rb-Protein hält
in seiner unphosphorylierten Form eine Reihe von Proteinen, die für
die Zellproliferation verantworlich sind, von ihrer Expression ab.
Das Protein ist permanent in der Zelle vorhanden und ändert nur
während der G0-Phase seinen Transkriptionsgrad. In Zellen in der
G0-Phase ist es unphophoryliert und hält Gene wir fos und myc von
ihrer Aktivität ab.
Wachstumsfaktoren führen zu einer Phosphorylierung des Proteins und
damit zu einer Aktivierung der Proliferation.
In der Hefe kann man den Zellzyklus in drei Teilzyklen aufteilen, die
allerdings untereinandervernetzt sind:
Der Chromosomenzyklus regelt die Verdoppelung und die Aufteilung der
Chromosomen, der cytoplasmatische Zyklus von Knospung und
Kernwanderung ist von dem Chromosomencyklus unabhängig und der
Centrosomenzyklus besteht aus den Vorgängen, die für die Aufteilung es
Spindelkörpers verantwortlich sind. Die Zyklen werden von
unterschiedlichen Cyklinen kontorlliert.
Der Eintritt in den Zyklus über START hinweg wird von CDC28, dem
Hologon von cdc2 kontrolliert. Mutationen in diesem Gen stoppen alle
drei Zyklen.
Das Tumorsupressorgen Rb ist ein Substrat für Cdk-Cyklin-D-Komplexe
bei Eukaryonten. Es wirkt in der G1-Phase vor dem Erreichen des
Restriktionspunkts. Zu vor ist es an den Transkriptionsfaktor E2F
gebunden und verhindert so die S-Phase und unterdrückt die
Transkription einiger anderer Gene. Am Restriktionspunkt wird Rb
phosphoryliert und entlässt E2F.
Man vermutet, dass durch Rb die Zellen in der G1- oder G0-Phase
gehalten werden. Wachstumshemmende Signale wirken über die Inhibition
der Cdk-Cyklin-Kinasen und verhindern die Phosphorylierung von Rb.
Weitere Inhibitoren sind p15, das Cdk4 und Cdk6 bindet und den
G0/G1-Übergang reguliert, p16, das eine Phosphorylierung von Rb
verhindert, p21, einem universellen Cdk-Inhibitor und p27, das
ebenfalls relativ wahllos Cdk-Cyklin-Komplexe und blockiert die
S-Phase. Die beiden zuletzt genannten Faktoren sind von Rb
unabhängig.
Die Zellalterung beruht sehr wahrscheinlich darauf, dass die Zelle mit
zunehmender Anzahl an Zellteilungen mit einer höheren
Wahrscheinlichkeit in die G0-Phase eintritt. Zellen aus Tieren mit
kurzer Lebenserwartung oder alten Menschen teilen sich weniger oft als
solche aus Tieren mit langer Lebenserwartung oder jungen Menschen.
Der Mechanismus wied die Funktion der Zellalterung sind nicht
bekannt. Eine der am besten belegten Theorien beruht auf den
Telomeren. Man nimmt an, dass diese an Enden der Chromosomen liegenden
Abschnitte, die mittels der Telomerase repliziert werden mit der Zeit
unexakt repliziert werden und so für das Altern verantworlich sind.
Bei den Eukaryonten ist es ein wichtiger Teil der Entwicklung, dass
einige Zellen in die Apoptose, den kontrollierten Zelltod gehen.
Die Apoptose kann durch den Mangel an GF, durch eine Behandlung mit
Glucocorticoiden, durch 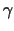 -Strahlen oder durch Aktivierung
bestimmter Rezeptoren ausgelöst. Des weiteren kann die Apoptose durch
den Angriff von T-Killerzellen oder zur Verhinderung durch p53
eingeleitet werden. -Strahlen oder durch Aktivierung
bestimmter Rezeptoren ausgelöst. Des weiteren kann die Apoptose durch
den Angriff von T-Killerzellen oder zur Verhinderung durch p53
eingeleitet werden.
Untersuchungen an dem Oberflächenprotein Fas haben ergeben, dass
dieses durch Antikörper aktiviert werden kann. Fas weist eine hohe
Ähnlichkeit mir dem TNF (Tumor-Nekrose-Faktor) auf. Bei Vergleichen
der beiden Rezeptoren kann man eine sogenannte Todesdomäne von ca. 80
AS länge identifizieren. Man konnte einige Proteine identifizieren,
die spezifisch mit der Todesdomäne interagieren und Apoptose
auslösen.
Der weitere Verlauf wird u.a. durch die ICE-Proteasen gesteuert. Diese
werden durch Spaltung eines Propeptids aktiviert. Bei Säugern findet
man ca. 8 ICE-ähnliche Proteine. Die Substrate dieser Proteasen sind
noch unbekannt.
Die T-Lympozyten initiiteren die Apoptose durch die Bildung einer
wässrigen Pore mittels Perforin und Serinproteasen. Dieser Angriff
aktiviert in der Zelle das ICE-verwandte Enzym Ich-3.
Bei C. elegans fand man sowohl Zellen, die den Zelltod verhindern, als
auch solche, die ihn initiieren. Analoge Gene konnte man auch bei den
Säugern finden.
Mitose
Als Mitose wird der Schritt der Kernteilung innerhalb des Zellzyklus
bezeichnet.
Die Teilungsphase der Zelle wird durch die Kondensation der
Chromosomen (verursacht durch die Phosphorylierung des Histons H1)
eingeleitet. Diese wiederum führt dazu, dass sich die Chromosomen
trennen und es durch diese Mitose zu der Ausbildung von zwei
Zellkernen kommt (hierfür sind die MT verantworlich) und ausserdem
bildet sich durch das Aktin der kontraktile Ring, durch den die
Cytokinese, die Trennung der Zellen eingeleitet wird.
In der Zelle werden die MT von dem Centrosom aus organisiert. Dieses
besteht aus einem amorphen Proteingemisch und zwei Centriolen. Das
Centrosom muss vor der Zellteilung verdoppelt werden. Die beiden
Centrosome bilden dann die Polse der Mitosespindel.
Die Centrosomen verdoppeln ihre Centriolen (über deren Funktion noch
nichts genaues bekannt ist) unabhängig vom Zellkern.
Die M-Phase wird traditionell in folgende Stadien unterteilt:
![\begin{entry}
\item [Prophase] \mbox{} \\
Die Chromosomen bestehen aus Schwes...
...ndung der Zellen -- der Mittelkörper -- noch einige Zeit
bestehen.
\end{entry}](img13.png)
Die Organellen, die von der Zelle nicht de novo synthetisiert werden
können, wie ER, Golgi, Mitochondrien und Chrloroplasten werden bei der
Mitose auf die beiden Tochterzellen verteilt.
Bei der Bildung der Mitosespindel verändert sich das Verhalten der MT:
Die dynamische Instabilität nimmt zu - abgesehen von einigen
Astral-MT, die die Mitosespindel bilden. Die polaren Enden dieser sich
gegenüberliegender MT nehmen Kontakt zueinander auf und bilden in
dieser Überschneidungszone ein vor Abbau schützendes Netzwerk
aus. Dieser Mechanismus dient wohl unter anderem dazu, die sich
trennenden Pole auseinander zu schieben.
Die zu beginn der M-Phase bereits replizierten Chromosomen bestehen
aus zwei Schwesterchromatiden , die über ein Centromer verbunden
sind. An den beiden Centromeren bildet sich in der Prophase ein
Proteinkomplex, der Kinetochor. Diese zeigen in entgegengesetzte
Richtung und binden an die sogenannten Kinetochor-MT.
Die Bildung des Kinetochors wird durch eine spezifische DNA-Sequenz
induziert. Die Kinetochore bestehen sehr wahrscheinlich in
modifizierter Form während des gesamten Zellzyklus, wie man mit
Antikörpern nachweisen konnte.
Die Kintochore suchen den Kontakt zu den MT und werden dann - sobald
sie an diese gebunden haben - zu den Spindelpolen
transportiert. Dieser Transport ist wahrscheinlich durch Dynein
vermittelt. Auch während das Chromosom gebunden ist, baut der MT an
seinem (+)-Ende weitere Tubulinmoleküle ein. Ein weiteres Phänomen,
das bewirkt, dass sich alle anderen Objekte, wie z.B. ein künstlich
abgetrennter Teil des Chromosoms von den Polen wegbewegt werden, ist
noch nicht geklärt.
Die Verbindung zwischen einem MT und einem Chromosom stabilisiert sich
vor allem dann, wenn die Verbingung unter Spannung steht. Dies führt
dazu, dass die Verbindung vor allem dann stabilisiert wird, wenn zwei
MT unterschiedlicher Pole an die Kinetochore gebunden haben und
Spannung ausüben. So wird verhindert, dass an den beiden Kinetochoren
eines Chromosoms MT des gleichen Pols angreifen.
Bei der Ausrichtung der Chromosomen gibt es zwei Hypothesen. Die eine
postuliert eine Abhängigkeit der Kraft von der Länge der MT, während
die andere das oben erwähnte Phänomen des Schubs dafür verantworlich
macht, dass sich die Chromosomen in der Metaphasenplatte anordnen.
Während der gesamten Metaphase fluktuiert die Position der Chromosomen
zwar ständig, allerdings wird sie im Mittel von den MT konstant
gehalten.
Während der gesamten Metaphase bewegen sich die Tubulin-Untereinheiten
nach dem Tretmühlenprinzip kontinuierlich polwärts.
In der Anaphase spalten sich die Chromatidien auf ein unbekanntes
Signal hin in zwei Chromosomen. In der ersten Phase, der Anaphase A
werden die Kinetochor-MT durch einen relativ schnellen Abbau am
(+)-Ende verkürzt, so dass sich die Chromosomen auseinander
bewegen. Der genaue Mechanismus ist nicht bekannt. Er könnte auf
Motorproteinen oder auf Proteinen mit einer hohen Affinität zu
polymerisiertem Tubulin beruhen.
In der Anaphase B weichen die Pole selbst auseinander; dies
beruht aus einem Wachstum der polaren MT, die die Mitosespindel bilden
an deren (+)-Ende.
Man vermutet, dass der Mechanismus auf zwei Mechanismen beruht. Zum
einen werden die polaren MT in der Spindel - sehr wahrscheinlich
durch Kinesine - auseinander geschoben und gleichzeitig werden wohl
auch Astral-MT an der Zellrinde binden und die Pole
auseinanderziehen.
In der Telophase muss sich die Kernhülle neu bilden. Dazu müssen sich
die Kern-Innen- und Aussenhülle neu bilden und mit der Lamina und den
Poren zu einem Zellkern organisieren. Durch den Wegfall der Aktivität
von MPF können die Phosphatasen verschiedene Proteine
dephsophorylieren. Dann folgt die Anlagerung und Fusion der
Kernmembranvesikel an die Chromosomen, so dass sich zunächst ein
kleiner Komplex um die Chromosomen bildet. Die Laminine bilden eine
neue Kernfaserschicht - sehr wahrscheinlich durch das während der
gesamten Mitose and die Membranvesikel gebunden Lamin B. Dann lagern
sich die Kernporen zusammen und beginnen damit, die Kernproteine in
den Kern zu transportieren.
Cytokinese
Die ersten Anzeichen der Furchung der Zelle treten in der Anaphase
auf: Es bilden sich leichte Runzeln und Furchen. Deren Lage wird durch
die Lage der polaren MT festgelegt. Die Teilungsfurche bildet sich
immer in einem rechten Winkel zu den polaren MT. So wurd eine
gleichmässige Aufteilung der Chromosomen auf die Zellen
gewährleistet.
Das genaue Signal ist nicht bekannt. Es könnte auf den Astral-MT oder
einem Calciumgradienten beruhen.
Die Teilungsfurche wird durch den aus Aktin und Myosin II bestehenden
kontraktilen Ring gebildet.
Der Ring besteht immer aus einem Bündel von mehr als 20
Aktin-Filamenten und wird zur Mitte hin nicht dicker, was bedeutet,
dass er Filamente verliert.
Bei der Embryonalentwicklung kann es dazu kommen, dass Zellen
assymetrisch geteilt werden.
Bei den pflanzlichen Zellen bildet sich in der Zelle eine neue
Zellwand, die die neu entstandenen Zellen trennen. Dazu bildet sich
zunächst die frühe Zellplatte, indem sich Vesikel aus dem Golgi an den
ehemaligen polaren MT (nun Phragmoplast-MT genannt) sammeln und dort
die frühe Zellplatte bilden. Diese wird
durch weitere Membranvesikel vergrössert und verschmilzt am Ende mit
der Plasmamembran der Zelle.
Die Lage dieser Zellplatte steht schon in der G2-Phase fest. Dort wird
ein sogenanntes Präprophase-Band aus MT gebildet, das um die Zelle
herumläuft. Das Band verschwindet in der Metaphase, scheint aber zuvor
die Trennlinie der Zelle festzulegen.
|





